题目内容
【题目】某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
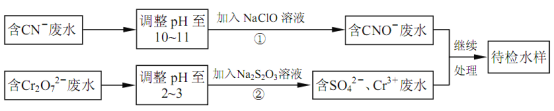
完成下列填空:
(1)HCN有剧毒,电子式是___,其分子属于___(填“极性”、“非极性”)分子。
(2)选用最详尽描述核外电子运动状态的方式,来表示氮原子的最外层电子:___,氮原子核外有___种能量不同的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是___。
a.相同条件下水溶液的酸性:HClO3>H2SO3
b.稳定性:HCl>H2S
c.相同条件下水溶液的pH:Na2S>NaCl
d.还原性:S2->Cl-
(4)写出流程②的离子方程式:___。
(5)反应②中,每消耗1.5mol Cr2O72-转移电子的数目为___个。
(6)取少量待检水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,用平衡移动原理解释产生该现象的原因___。
【答案】![]() 极性
极性 ![]() 3 bd 3S2O32+4Cr2O72+26H+=6SO42+8Cr3++13H2O 9.0NA(或5.418×1024) 待检水样中还有Cu2+,加碱发生Cu2++2OH═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2(aq)═CuS(s)+2OH(aq),使沉淀向更难溶方向转化
3 bd 3S2O32+4Cr2O72+26H+=6SO42+8Cr3++13H2O 9.0NA(或5.418×1024) 待检水样中还有Cu2+,加碱发生Cu2++2OH═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2(aq)═CuS(s)+2OH(aq),使沉淀向更难溶方向转化
【解析】
(1)HCN是共价化合物,根据电子式的书写方法来回答,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子;
(2)轨道表示式可以详尽描述氧原子的核外电子运动状态的方式;
(3)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断;
(4)在酸性环境下,重铬酸根离子可将硫代硫酸根离子氧化,据此书写离子方程式;
(5)利用反应:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O来计算每0.5molCr2O72-转移的电子数;
(6)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析。
(1)HCN是共价化合物,电子式为:![]() ,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子;
,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子;
(2)轨道表示式可以详尽描述氧原子的核外电子运动状态的方式,即![]() ,核外电子排布式:1s22s22p4,核外有3种不同能量的电子;
,核外电子排布式:1s22s22p4,核外有3种不同能量的电子;
(3)a.相同条件下水溶液的pH:NaClO>Na2S2O3,则酸性是:HClO<H2S2O3,但是元素对应最高价氧化物的水化物的酸性强弱才能说明氯元素的非金属性比硫元素强,故a不符合题意;
b.元素的非金属性越强,对应氢化物的稳定性越强,氯化氢比硫化氢稳定,稳定性:HCl>H2S,故b符合题意;
c.Na2S强碱弱酸盐,硫离子在溶液中水解使溶液显碱性,NaCl是强酸强碱盐,不水解,溶液显中性,则相同条件下水溶液的pH:Na2S>NaCl,不能用非金属性的强弱来说明,故C不符合题意;
d.还原性:H2S>HCl,即氯气与H2S能发生置换反应,说明氯气的氧化性大于S,元素的非金属性Cl大于S,故d符合题意;
故选bd;
(4)在酸性环境下,重铬酸根离子氧化性可将硫代硫酸根离子氧化为硫酸根离子,自身被还原为Cr3+,即3S2O32+4Cr2O72+26H+=6SO42+8Cr3++13H2O;
(5)根据反应:3S2O32+4Cr2O72+26H+=6SO42+8Cr3++13H2O,每4molCr2O72被还原转移的电子是24mol,所以每1.5molCr2O72转移的电子数9.0NA(或5.418×1024);
(6)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案