题目内容
【题目】经检测,某工业废水显酸性,且废水中含有大量Na+、Cu2+、Cl-、SO42-、NO3-,
(1)下列离子中,不可能大量存在于该废水中的是___(填序号)。
A.K+ B.Fe3+ C.Ag+ D.HCO3-
(2)若向上述废水中加入大量的过氧化钠固体,观察到的现象为___;相关的离子方程式为___。
(3)若工业废水中只含有H+和Na+、Cu2+、Cl-、SO42-、NO3-,经分析测得,H+、Cu2+、Cl-、SO42-、NO3-的物质的量浓度分别为:0.1mol·L-1、0.05mol·L-1、0.2mol·L-1、0.1mol·L-1、0.1mol·L-1,则Na+的物质的量浓度为___。
(4)设计实验方案除去原废水中的Cu2+和SO42-(用流程图表示)(提示:加入的试剂要过量)___。
【答案】CD 有气体产生,有蓝色沉淀生成 2Na2O2+2H2O=4Na++4OH-+O2↑、Cu2++2OH-=Cu(OH)2↓或2Na2O2+2H2O+Cu2+=2Cu(OH)2↓+O2↑+4Na+ 0.3mol·L-1 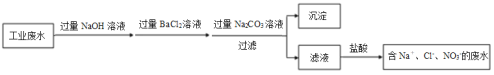
【解析】
(1)酸性废水中,HCO3-不能大量存在;废水中含Cl-,Ag+不能大量存在。
(2)若向上述废水中加入大量的过氧化钠固体,过氧化钠与水反应,生成NaOH和O2,NaOH能沉淀Cu2+。
(3)若工业废水中只含有H+和Na+、Cu2+、Cl-、SO42-、NO3-,经分析测得,H+、Cu2+、Cl-、SO42-、NO3-的物质的量浓度分别为:0.1mol·L-1、0.05mol·L-1、0.2mol·L-1、0.1mol·L-1、0.1mol·L-1,利用电荷守恒,即c(Na+)+ c(H+)+2c(Cu2+)= c(Cl-)+ 2c(SO42-)+ c(NO3-),代入数据,即可求出c(Na+)。
(4)除去原废水中的Cu2+和SO42-,需加入NaOH和BaCl2,过量的BaCl2用Na2CO3去除,过量的NaOH、Na2CO3用盐酸去除。
(1)酸性废水中含有H+,HCO3-不能大量存在;废水中含Cl-,Ag+不能大量存在。答案为:CD;
(2)若向上述废水中加入大量的过氧化钠固体,过氧化钠与水反应,生成NaOH和O2,NaOH能沉淀Cu2+。观察到的现象为有气体产生,有蓝色沉淀生成;相关的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑、Cu2++2OH-=Cu(OH)2↓或2Na2O2+2H2O+Cu2+=2Cu(OH)2↓+O2↑+4Na+。答案为:有气体产生,有蓝色沉淀生成;2Na2O2+2H2O=4Na++4OH-+O2↑、Cu2++2OH-=Cu(OH)2↓或2Na2O2+2H2O+Cu2+=2Cu(OH)2↓+O2↑+4Na+;
(3)利用电荷守恒,c(Na+)+ 0.1mol·L-1+2×0.05mol·L-1=0.2mol·L-1+ 2×0.1mol·L-1+0.1mol·L-1,可求出c(Na+)= 0.3mol·L-1。答案为:0.3mol·L-1;
(4)除去原废水中的Cu2+和SO42-,需加入NaOH和BaCl2,过量的BaCl2用Na2CO3去除,过量的NaOH、Na2CO3用盐酸去除。答案为:


 阅读快车系列答案
阅读快车系列答案