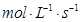题目内容
已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g) CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
(1)求4 min内H2的平均化学反应速率。
(2)计算800℃时该反应的平衡常数。
(3)427℃时该反应的化学平衡常数为9.4,请结合(2)中的计算结果判断该反应的ΔH 0(填“>”、“<”或“=” )。
 CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。(1)求4 min内H2的平均化学反应速率。
(2)计算800℃时该反应的平衡常数。
(3)427℃时该反应的化学平衡常数为9.4,请结合(2)中的计算结果判断该反应的ΔH 0(填“>”、“<”或“=” )。
(1)0.15mol/(L·min) (2)1 (3)ΔH<0
试题分析:(1)△c(CO)=△n(CO)/V=
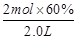 =0.6mol/L (1分)
=0.6mol/L (1分)v(CO)=△c(CO)/△t=
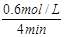 =0.15mol/(L·min) (1分)
=0.15mol/(L·min) (1分)由题可得, v(H2)=v(CO)=0.15mol/(L·min) (1分)
(2)根据题意可得,
(mol/L) CO(g) + H2O (g)
 CO2(g) +H2(g) (1分)
CO2(g) +H2(g) (1分)开始 1.0 1.5 0 0
反应 0.6 0.6 0.6 0.6
平衡 0.4 0.9 0.6 0.6 (1分)
则800℃时平衡常数
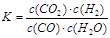 =
= (2分)
(2分)(3)<(2分)[说明:由于800℃时K=1,427℃时K=9.4,温度降低,平衡常数增大,说明降低温度平衡往放热(正反应)方向移动,故ΔH<0。

练习册系列答案
相关题目
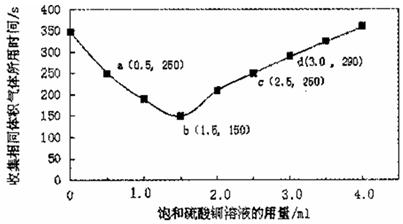
 NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
 2NH3(g)。在相同时间内表示该反应速率最快的是
2NH3(g)。在相同时间内表示该反应速率最快的是 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法: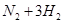

 的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4
的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4 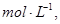 则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
则以氢气的浓度变化表示该反应在2 s内的平均反应速率是