题目内容
某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,
原因为 ;反应速率最小的时间段是 ,
原因为 。(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液, 你认为可行的是 。
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,
原因为 ;反应速率最小的时间段是 ,
原因为 。(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液, 你认为可行的是 。
(11分)(1)2~3 min(1分),因该反应是放热反应,此时温度高(2分);4~5 min (2分),因为此时H+ 浓度小(2分)(时间段错误,不得分)
(2)υ(HCl)=0.1 mol/(L·min)(2分,无单位或单位错误扣1分)
(3)A、B (各1分,共2分,多选1个扣1分)
(2)υ(HCl)=0.1 mol/(L·min)(2分,无单位或单位错误扣1分)
(3)A、B (各1分,共2分,多选1个扣1分)
试题分析:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、120ml-50ml=70mL、232ml-120ml=112mL、290ml-232ml=68mL、310ml-290ml=20mL,由此可知反应速率最大的时间段为2~3 min。这是由于该反应为放热反应,温度升高,温度对反应速率的影响超过浓度对反应速率的影响,所以反应速率增大。反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,即浓度对反应速率的影响超过温度对反应速率的影响,因此反应速率降低。
(2)在2~3min时间段内,n(H2)=0.112L÷22.4L/mol==0.005mol,根据2HCl~H2可知,消耗盐酸的物质的量为0.01mol,其浓度为0.01mol÷0.1L=0.1mol/L,则υ(HCl)=0.1mol/L÷1min=0.1 mol/(L?min)。
(3)A、加入蒸馏水,H+浓度减小,反应速率减小,且不减少产生氢气的量,故A正确;B、加入Na2SO4溶液,相当于稀释,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;C、加入NaNO3溶液,在酸性条件下NO3-具有强氧化性,与金属反应得不到氢气,而是生成NO气体,影响生成氢气的量,故C错误;D、加入CuSO4溶液,Zn置换出Cu反应速度增大。但由于消耗锌,从而影响生成氢气的量,故D错误;E、加入Na2CO3溶液,消耗H+,H+浓度减小,影响生成氢气的量,故E错误,所以答案选AB。

练习册系列答案
相关题目
 CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。 2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法:
2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法: ?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( ) 2HI
2HI CO2+H2,在最初5秒钟内,一氧化碳的平均反应速率是0.02 mol·l-1·s-1求:
CO2+H2,在最初5秒钟内,一氧化碳的平均反应速率是0.02 mol·l-1·s-1求: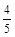 υ(NH3) =υ(O2)
υ(NH3) =υ(O2)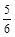 υ(O2) =υ(H2O)
υ(O2) =υ(H2O)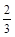 υ(NH3) =υ(H2O)
υ(NH3) =υ(H2O)