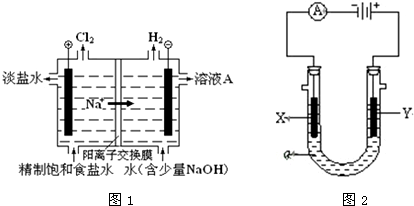
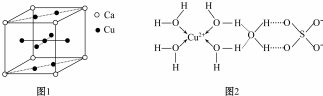
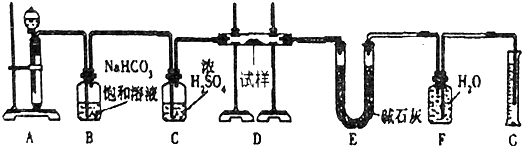
题目内容
20.X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:| X的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的族序数是周期序数的三倍 |
| Z元素的电负性在所有元素中最大 |
| W原子的第一至第六电离能分别为:I1=578KJ•mol-1,I2=1817KJ•mol-1,I3=2745KJ•mol-1,I4=11575KJ•mol-1,I5=14830KJ•mol-1,I6=18376KJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R原子最高能层上只有1个单电子,其余各能层均已充满电子. |
(1)R在周期表中位于ds区,写出R基态原子的价电子排布式3d104s1.
(2)X与Y形成的二元化合物中属于非极性分子的CO2 (用化学式表示).
(3)写出Z元素的单质与水反应的方式2F2+2H2O=4HF+O2,此反应中氧化剂与氧化产物物质的量之比为2:1.
(4)X的氯化物的熔点比Q的氯化物的熔点低(“高”或“低”),理由是CCl4属于分子晶体,KCl属于离子晶体.
(5)光谱证实单质W与强碱性溶液反应有[W(OH)4]-生成,则中[W(OH)4]--存在acd(填选项字母)
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键
(6)金刚砂(SiC)的结构与金刚石(4个碳原子在立方体体内,其余碳原子分别位于面心和顶角)相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.
分析 X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大,X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则核外电子排布为1s22s22p2,则X为C元素;Y元素的族序数是其周期数的三倍,原子只能有2个电子层,最外层电子数为6,则Y为O元素;Z元素的电负性在所有元素中最大,则Z为F元素;Q为前四周期中电负性最小的元素,则Q为钾元素;W原子的第四电离能剧增,表现+3价,原子序数小于K,则W为Al元素;R处于第四周期,R原子最高能层上只有1个单电子,其余各能层均已充满电子,原子核外电子数为2+8+18+1=29,故R为Cu,据此解答.
解答 解:X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大,X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则核外电子排布为1s22s22p2,则X为C元素;Y元素的族序数是其周期数的三倍,原子只能有2个电子层,最外层电子数为6,则Y为O元素;Z元素的电负性在所有元素中最大,则Z为F元素;Q为前四周期中电负性最小的元素,则Q为钾元素;W原子的第四电离能剧增,表现+3价,原子序数小于K,则W为Al元素;R处于第四周期,R原子最高能层上只有1个单电子,其余各能层均已充满电子,原子核外电子数为2+8+18+1=29,故R为Cu.
(1)R为Cu,处于周期表中第四周期第IB族,属于ds区元素,基态原子的价电子排布式为3d104s1,
故答案为:ds;3d104s1;
(2)X与Y形成的二元化合物由CO、CO2,属于非极性分子的是CO2,
故答案为:CO2;
(3)Z元素的单质与水反应的方式为:2F2+2H2O=4HF+O2,此反应中氧化剂为F2,氧化产物为O2,氧化剂与氧化产物物质的量之比为2:1,
故答案为:2F2+2H2O=4HF+O2;2:1;
(4)X的氯化物为CCl4,属于分子晶体,Q的氯化物为KCl,属于离子晶体,故熔点CCl4<KCl,
故答案为:低;CCl4属于分子晶体,KCl属于离子晶体;
(5)[Al(OH)4]-中氢原子和氧原子之间存在极性共价键,为σ键,铝原子含有空轨道,氧原子含有孤电子对,所以该离子中含有配位键,
故答案为:acd;
(6)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有硅原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,金刚砂中碳原子和硅原子个数之比为1:1,所以该晶胞中碳原子个数是4,每个硅原子连接4个C-Si键,所以硅原子的杂化方式为sp3,
故答案为:4;4;sp3.
点评 本题考查结构性质位置关系、核外电子排布规律、化学键、晶胞结构及计算等,难度中等,推断元素是解题关键,注意利用均摊法进行晶胞的有关计算.

| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | 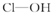 | 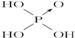 | 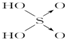 | 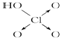 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
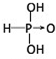 ,亚砷酸
,亚砷酸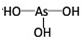 .
.(2)分别写出亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式.亚磷酸:H3PO3+2NaOH=Na2HPO3+2H2O,亚砷酸:H3AsO3+3NaOH=Na3AsO3+3H2O.
(3)比较H3AsO4、H2CrO4、HMnO4的酸性强弱,酸性由弱到强的顺序H3AsO4、H2CrO4、HMnO4.
(1)下列措施中,有利于降低大气中CO2浓度的有abc.(填字母编号)
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)另一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇的热化学方程式是:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol.
(3)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
| 温度(k) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比,CO2的转化率增大(填“增大”“减小”或“不变”).
②该反应的正反应为放(填“吸”或“放”)热反应.
③在图一的坐标系中作图,说明压强由p1增大到p2时,由于平衡移动引起H2转化率和乙醇百分含量的变化.


 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验: