题目内容
10.已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验.
主要实验步骤如下:
①按图组装仪器,并检验装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol•L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)在用托盘天平称量关品时,如果天平的指针向左偏转,说明样品重,砝码轻.
(2)装置中干燥管B的作用是防止空气中的CO2和水气进入U型管中.
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果偏高(填偏高、偏低或不变).
(4)步骤⑤的目的是把反应产生的CO2全部导入U型管中.
(5)步骤⑦的目的是判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收.
(6)试样中纯碱的质量分数的计算式为$\frac{106(d-b)}{44a}$×100%.
(7)还可以用其它实验方法测定试样中纯碱的质量分数.请简述一种不同的实验方法.
分析 (1)根据天平称量时按照左物右码的原则考虑;
(2)由于空气中也有二氧化碳和水分,干燥管B的作用就是不让它们进入的;
(3)根据盐酸的挥发性考虑;
(4)由于反应完了锥形瓶中存留有二氧化碳,鼓入一定量的空气就是为了驱赶它们的;
(5)就是为了将二氧化碳全部赶过去;
(6)根据U型管的质量的增加量就是生成的二氧化碳的质量,根据二氧化碳的质量算出碳酸钠的质量,再用碳酸钠的质量除以样品质量即可.
(7)可以根据用一种试剂与碳酸钠反应产生沉淀,根据沉淀算出碳酸钠的质量,再进行推算.
解答 解:(1)由于称量时左物右码,向左偏说明样品重,砝码轻,故答案为:样品重,砝码轻;
(2)U型管中的碱石灰是为了吸收反应生成的二氧化碳,但空气中也存在二氧化碳,干燥管B的作用就是防止空气中的二氧化碳和水分进入U型管,对结果产生误差,
故答案为:防止空气中的CO2和水气进入U型管中;
(3)由于盐酸具有挥发性,也会随着二氧化碳进入U型管,被误认为是二氧化碳,所以二氧化碳的质量偏大,算出的碳酸钠的质量也会偏大的,所以结果会偏大,
故答案为:偏高;
(4)由于反应完了锥形瓶中存留有二氧化碳,鼓入一定量的空气就是将残留的二氧化碳完全排入U型管,
故答案为:把反应产生的CO2全部导入U型管中;
(5)直到U型管的质量基本不变,说明二氧化碳已经被全部排到U型管中,
故答案为:判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收;
(6)设需要碳酸钠的质量为X则:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X d-b
解得X=$\frac{106(d-b)}{44}$
所以试样中纯碱的质量分数的计算式为$\frac{\frac{106(d-b)}{44}}{a}$×100%=$\frac{106(d-b)}{44a}$×100%,
故答案为:$\frac{106(d-b)}{44a}$×100%;
(7)根据用一种试剂与碳酸钠反应产生沉淀,根据沉淀算出碳酸钠的质量:取一定量试样放入烧杯中,加适量蒸馏水溶解,再向烧杯中滴加足量氢氧化钙溶液,将得到的沉淀过滤洗涤干燥后称量,根据方程式由沉淀质量算出碳酸钠质量,再除以样品质量.
答:取一定量试样放入烧杯中,加适量蒸馏水溶解,再向烧杯中滴加足量氢氧化钙溶液,将得到的沉淀过滤洗涤干燥后称量,根据方程式由沉淀质量算出碳酸钠质量,再除以样品质量.
点评 本题容易出错的地方是不设计干燥管B,忘记空气中的二氧化碳和水分也能够进入U型管中,会使结果偏大,题目难度中等.

 53天天练系列答案
53天天练系列答案(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和铜元素.
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.
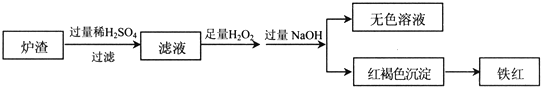
①滤液中的阳离子有Fe3+、Fe2+、H+、Al3+.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是c(填序号).
| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| C | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是1.5mol.
| A. | 在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 若pH>7,则一定是 c${\;}_{{1}_{\;}}$v1=c2v2 | |
| C. | 当pH=7时,若v1=v2,则一定是c2>c1 | |
| D. | 若v1=v2,c2=c1,则 c(CH3COO-)+c(CH3COOH)=c(Na+) |
| A. | 0.5 mol•L-1 | B. | l mol•L-1 | C. | 2 mol•L-1 | D. | 3 mol•L-1 |
| A. | K2CO3溶液中c(K+)与c(CO32-)之比 | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的盐酸中c(H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 | |
| D. | pH=12的KOH溶液与pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比 |
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: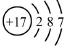 | |
| C. | 氯分子的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
| X的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的族序数是周期序数的三倍 |
| Z元素的电负性在所有元素中最大 |
| W原子的第一至第六电离能分别为:I1=578KJ•mol-1,I2=1817KJ•mol-1,I3=2745KJ•mol-1,I4=11575KJ•mol-1,I5=14830KJ•mol-1,I6=18376KJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R原子最高能层上只有1个单电子,其余各能层均已充满电子. |
(1)R在周期表中位于ds区,写出R基态原子的价电子排布式3d104s1.
(2)X与Y形成的二元化合物中属于非极性分子的CO2 (用化学式表示).
(3)写出Z元素的单质与水反应的方式2F2+2H2O=4HF+O2,此反应中氧化剂与氧化产物物质的量之比为2:1.
(4)X的氯化物的熔点比Q的氯化物的熔点低(“高”或“低”),理由是CCl4属于分子晶体,KCl属于离子晶体.
(5)光谱证实单质W与强碱性溶液反应有[W(OH)4]-生成,则中[W(OH)4]--存在acd(填选项字母)
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键
(6)金刚砂(SiC)的结构与金刚石(4个碳原子在立方体体内,其余碳原子分别位于面心和顶角)相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.