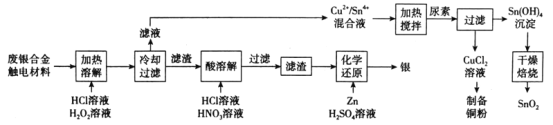
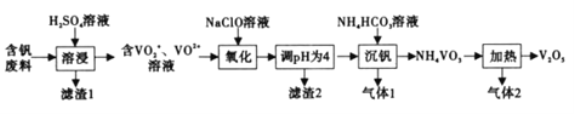
题目内容
【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,设计了如下探究实验方案:
实验 | 草酸溶液 (0.5mol/L) | 高锰酸钾 (0.5mol/L) | 稀硫酸 (0.5mol/L) | 硫酸锰 (0.5mol/L) | 温度 | 蒸馏水 |
① | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | 1.0 mL |
② | 10.0 mL | 2.0 mL | 3.0 mL | 1.0 mL | 25℃ | 0 |
③ | 8.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | Vx |
④ | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 35℃ | 1.0 mL |
回答下列问题:
(1)本方案中用于设计实验的化学反应的离子方程式是____,实验中预计通过观察什么现象或测定什么数据来进行判断:_____。
(2)该实验的目的是____。
(3)实验③中的Vx=____;实验①和④测得反应速率分别为v1、v4,则v1____v4(填:“>”“<”和“=”)
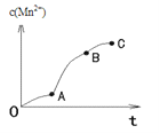
(4)实验①中,c(Mn2+)与t关系如图所示。AB段斜率明显大于OA段斜率,除反应可能放热外,猜想还可能是_____,利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
①补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量的____,最后加入1mL 0.1 mol/L草酸溶液。
②若猜想成立,应观察到的实验现象是_______。
【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 观察溶液紫红色褪去的快慢(或测定从反应开始至溶液紫红色褪去所用时间) 研究反应物浓度、催化剂(或Mn2+的催化作用)、温度对化学反应速率的影响 3.0 < 产物中的Mn2+对该反应有催化作用 MnSO4固体 加入草酸溶液后,溶液紫色迅速变浅
【解析】
(1)实验中酸性高锰酸钾溶液氧化草酸,据此书写反应的离子方程式;酸性高锰酸钾溶液为紫红色,实验中可通过观察溶液紫红色褪去的快慢或测定从反应开始至溶液紫红色褪去所用时间判断反应速率;
(2)结合表中数据分析判断该实验的目的;
(3)实验①和实验③中只有草酸的浓度不同,所以探究草酸浓度对反应速率的影响,因此溶液的体积应该相同;实验①和实验④中温度不同,温度越高,反应速率越快,据此判断v1、v4大小;
(4)由于生成物中有锰离子产生,还可能是产物中的Mn2+对该反应有催化作用。设计实验验证猜想时,可以加入MnSO4固体与实验II对比,若猜想成立,加入MnSO4固体溶液紫色应迅速变浅,据此分析解答。
(1)实验中酸性高锰酸钾溶液氧化草酸,反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;由于酸性高锰酸钾溶液为紫红色,所以实验中可通过观察溶液紫红色褪去的快慢或测定从反应开始至溶液紫红色褪去所用时间来判断反应速率,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;观察溶液紫红色褪去的快慢(或测定从反应开始至溶液紫红色褪去所用时间);
(2)结合表中数据可知,该实验的目的是研究反应物浓度、催化剂(或Mn2+的催化作用)、温度对化学反应速率的影响,故答案为:研究反应物浓度、催化剂(或Mn2+的催化作用)、温度对化学反应速率的影响;
(3)实验①和实验③中只有草酸的浓度不同,所以探究草酸浓度对反应速率的影响,因此溶液的体积应该相同,则实验③中的Vx=3.0;实验①和实验④中温度不同,温度越高,反应速率越快,则v1<v4,故答案为:3.0;<;
(4)由于生成物中有锰离子产生,所以AB段斜率明显大于OA段斜率,除了反应可能放热外,还可能是产物中的Mn2+对该反应有催化作用,故答案为:产物中的Mn2+对该反应有催化作用;
①要验证该反应中生成的Mn2+对反应有催化作用,可以通过加入MnSO4固体与实验II对比,其他条件与实验II相同,故实验Ⅲ的操作为:向试管中先加入1mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量MnSO4固体,最后加入1mL0.1mol/L草酸溶液,故答案为:MnSO4固体;
②若猜想成立,则实验III褪色迅速,可以观察到:加入草酸溶液后,溶液紫色迅速变浅,故答案为:加入草酸溶液后,溶液紫色迅速变浅。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案