题目内容
5.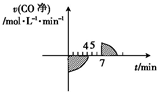 一氧化碳和氢气反应可生成甲醛:CO(g)+H2(g)?HCHO(g)△H<0,一定温度下,向恒容密闭容器中充入等物质的量的H2、CO和HCHO三种气体,测得CO的净反应速率(即正反应速率减去逆反应速率)随时间的变化曲线如图所示,其中第5min和第7min时分别改变了反应的一个条件,下列说法正确的是( )
一氧化碳和氢气反应可生成甲醛:CO(g)+H2(g)?HCHO(g)△H<0,一定温度下,向恒容密闭容器中充入等物质的量的H2、CO和HCHO三种气体,测得CO的净反应速率(即正反应速率减去逆反应速率)随时间的变化曲线如图所示,其中第5min和第7min时分别改变了反应的一个条件,下列说法正确的是( )| A. | 前4 min阴影部分的值为CO的物质的量浓度的变化量 | |
| B. | 前4 min反应向正方向进行 | |
| C. | 第5 min时改变的条件可能为向容器中再分别充入1 mol H2、1 mol CO和1 mol HCHO | |
| D. | 第7 min时改变的条件可能为降低反应温度 |
分析 由净反应速率定义分析可知,前4 min时CO的净反应速率为负值,所以反应向逆反应方向进行,故前4 min时阴影部分的值为CO的浓度增加量;第5 min时改变条件平衡不移动,故可能为加入催化剂;第7 min时改变条件,CO的净反应速率为正值,反应向正方向进行,据此分析.
解答 解:A、由净反应速率定义分析可知,前4 min时CO的净反应速率为负值,所以反应向逆反应方向进行,故前4 min时阴影部分的值为CO的浓度增加量,故A正确;
B、由净反应速率定义分析可知,前4 min时CO的净反应速率为负值,所以反应向逆反应方向进行,故B错误;
C、第5 min时改变条件平衡不移动,故可能为加入催化剂,不是再分别充入1 mol H2、1 mol CO和1 mol HCHO,故C错误;
D、第7 min时改变条件,CO的净反应速率为正值,反应向正方向进行,又该反应为放热反应,所以改变的条件可能为降低温度,故D正确;
故选:AD.
点评 本题考查化学平衡移动图象问题,题目难度中等,解答该题的关键是根据净反应速率判断平衡移动方向,判断温度对平衡移动的影响,注意平衡移动原理等.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
16.已知25℃时:
①HF(aq)+OH-(aq)?F-(aq)+H2O(1)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ/mol
下列有关说法中正确的是( )
①HF(aq)+OH-(aq)?F-(aq)+H2O(1)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ/mol
下列有关说法中正确的是( )
| A. | HF电离吸热 | |
| B. | 水解消耗0.1 mol F时,吸收的热量为6.77 kJ | |
| C. | 中和热均为57.3 kJ/mol | |
| D. | 含0.1 mol HF、0.1 mol NaOH的两种溶液混合后放出的热量为6.77 kJ |
20.表是元素周期表的一部分,表中所列的数字分别代表某一化学元素.

(1)某元素原子的核外所有p电子数比s电子总数少1,则该元素的元素符号是N.
(2)元素⑨的基态原子的外围电子排布式是3d54s1,该元素的最高正价是+6.
(3)元素⑩在周期表中的位置是第四周期、第Ⅷ族、d区.
(4)表中元素⑥的氢化物的还原性比元素⑤的氢化物的还原性弱(填强或弱)
(5)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.下表是一些气态原子失去核外不同电子所需的能量(电离能)(KJ•mol-):
表中X可能为以上10种元素中的铝元素(填元素名称);为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量Li原子失去1个电子后形成全充满的稳定结构,能量较低,难于再失去第二个电子.

(1)某元素原子的核外所有p电子数比s电子总数少1,则该元素的元素符号是N.
(2)元素⑨的基态原子的外围电子排布式是3d54s1,该元素的最高正价是+6.
(3)元素⑩在周期表中的位置是第四周期、第Ⅷ族、d区.
(4)表中元素⑥的氢化物的还原性比元素⑤的氢化物的还原性弱(填强或弱)
(5)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.下表是一些气态原子失去核外不同电子所需的能量(电离能)(KJ•mol-):
| 锂 | X | |
| 失去第一个电子(I1) | 519 | 580 |
| 失去第二个电子(I2) | 7296 | 1820 |
| 失去第三个电子(I3) | 11799 | 2750 |
| 失去第四个电子(I4) | 11600 |
10.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
17.已知M为质量数为27,中子数为14的元素形成的单质,则下列物质不能与M反应的是( )
| A. | AgNO3溶液 | B. | NaOH溶液 | C. | Fe3O4 | D. | MgO |
14.下列几种物质的保存方法中,不正确的是( )
| A. | 氯化铁溶液保存时加入少量的盐酸 | B. | 氯水保存在棕色瓶里并放在冷暗处 | ||
| C. | 漂白粉可以在敞口容器中长期存放 | D. | 溴水盛放在有玻璃塞的细口瓶中 |
15.化学反应都伴随着能量的变化,通常表现为热量的变化,以下叙述正确的是( )
| A. | 对于吸热反应,由于吸收热量后反应体系的温度升高 | |
| B. | 对于吸热反应,生成物的总能量,高于反应物的总能量 | |
| C. | 对于放热反应,放出热量后反应体系的温度降低 | |
| D. | 对于放热反应,生成物的总能量高于反应物的总能量 |
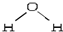 ,折线型结构,正负电荷的重心不能重合,因此为极性分子;CO2的结构式为 O═C═O,正负 电荷的重心重合,为非极性分子.又知极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,叫相似相溶原理.
,折线型结构,正负电荷的重心不能重合,因此为极性分子;CO2的结构式为 O═C═O,正负 电荷的重心重合,为非极性分子.又知极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,叫相似相溶原理. →
→ .
.