题目内容
【题目】在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
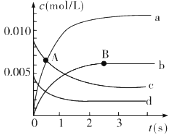
反应过程如图所示,其中只有3条曲线是正确的。请回答:
(1)A点处,v(正)____v(逆) (填“大于”“小于”或“等于”,下同),A点正反应速率_______B点正反应速率。
(2)图中表示NO2的变化的曲线是___。用O2表示从0~2 s内该反应的平均速率v=__。
(3)能说明该反应已经达到平衡状态的是________ (填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________(填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.减小O2的浓度 d.选择高效的催化剂
【答案】> > b 0.0015 mol/(L·min) bc bd
【解析】
(1)化学反应正向进行,正反应速率大于逆反应速率;逆向进行,正反应速率小于逆反应速率;
(2)根据一氧化氮的平衡浓度仪器变化浓度计算氧气的平衡浓度,根据公式v=![]() 计算化学反应速率;
计算化学反应速率;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)一般增大反应物的浓度、增大压强,升高温度、使用催化剂,化学反应速率加快,以此来解答。
(1)根据反应中,一氧化氮的浓度逐渐减小可知:该反应是正向进行建立平衡的,所以A点正反应速率大于逆反应速率;随着反应的进行,反应物的浓度减小,反应速率减慢,A点费用正向进行,B点反应达到平衡状态,所以A点速率大于B点速率;
(2)反应中NO的浓度变化量△c(NO)=![]() =0.0065mol/L,所以O2的浓度减小量是0.00375mol/L,根据方程式的系数关系可知NO2浓度变化量△c(NO2)=△c(NO)= 0.0065mol/L,所以图中表示NO2的变化的曲线是b曲线,从0~2s内用NO浓度变化表示反应速率为v(NO)=
=0.0065mol/L,所以O2的浓度减小量是0.00375mol/L,根据方程式的系数关系可知NO2浓度变化量△c(NO2)=△c(NO)= 0.0065mol/L,所以图中表示NO2的变化的曲线是b曲线,从0~2s内用NO浓度变化表示反应速率为v(NO)=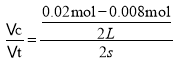 =0.003mol/(Ls);由于v(NO):v(O2)=2:1,所以v(O2)=
=0.003mol/(Ls);由于v(NO):v(O2)=2:1,所以v(O2)=![]() v(NO)= 0.0015 mol/(L·min);
v(NO)= 0.0015 mol/(L·min);
(3) b.在任何时刻都存在速率关系v(NO)=2v(O2),所以不能据此判断正逆反应速率相等,反应不一定平衡,a错误;
b.反应在恒容密闭容器内进行,由于反应前后气体的物质的量不相等,若容器内压强保持不变,说明气体的物质的量不变,反应达到平衡状态,b正确;
c.在任何时刻都存在速率关系v(NO)正=2v正(O2),若v逆(NO)=2v正(O2),则v(NO)正= v逆(NO),反应处于平衡状态,c正确;
d.反应前后气体的质量不变,容器的容积不变,因此无论反应是否处于平衡状态,容器内的密度保持不变,故不能据此判断反应处于平衡状态,d错误;
故合理选项是bc;
(4)a.及时分离出NO2气体,会使物质的浓度降低,因此会降低反应速率,a错误;
b.适当升高温度,物质的内能增加,分子之间的有效碰撞次数增加,反应速率加快,b正确;c.减小O2的浓度,物质单位体积内有效碰撞次数减小,反应速率降低,c错误;
d.选择高效的催化剂可以大大加快反应速率,d正确;
故合理选项是bd。