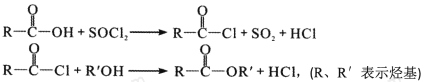
题目内容
【题目】(1)铅蓄电池的正极的反应式_________。
(2)由 Mg、Al和氢氧化钠溶液组成的原电池中,负极的反应式 ________。当在电极上产生气体3.36L(标准状况)时,导线中通过的电子电子数目为_____个(用 NA表示阿伏加德罗常数的值)。
(3)日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池结构如下图所示,据此回答下列问题:

a极为电池的____极,b电极上的电极反应式为____。电池工作时电流的方向是由_______(填“a”或“b”, 下同)经导向______。电池工作时,若有0.1mol二甲醚被氧化时,有_______mol电子发生转移。
【答案】PbO2+2e+SO42-+4H+=PbSO4+2H2O Al+4OH--3e-=AlO2-+2H2O 0.3NA 负 O2+4H++4e-=2H2O b a 1.2
【解析】
(1)铅蓄电池中PbO2为正极,发生还原反应;
(2)由 Mg、Al和氢氧化钠溶液组成的原电池中,Al为负极,失去电子,产生的Al3+与溶液中的OH-结合形成AlO2-,在正极上水电离产生的H+获得电子变为H2逸出,根据同一闭合回路在电子转移数目相等计算电子转移数目;
(3)通入燃料二甲醚的电极为负极,失去电子,发生氧化反应;通入O2的电极为正极,正极上O2获得电子,与溶液中的H+结合形成水,电流方向为正电荷移动方向;根据同一闭合回路中电子转移数目相等,结合总反应方程式计算。
(1)在铅蓄电池中,Pb为负极,PbO2为正极,在正极上PbO2获得电子,与溶液中的H+结合生成水,PbO2获得电子变为Pb2+,与溶液中的SO42-结合形成PbSO4,电极反应式为PbO2+2e+SO42-+4H+=PbSO4+2H2O;
(2)由 Mg、Al和氢氧化钠溶液组成的原电池中,Al为负极,失去电子,产生的Al3+与溶液中的OH-结合形成AlO2-,因此负极的电极反应式为:Al+4OH--3e-=AlO2-+2H2O;n(H2)=![]() =0.15mol,n(e-)=2n(H2)=2×0.15mol×NA/mol=0.3NA;
=0.15mol,n(e-)=2n(H2)=2×0.15mol×NA/mol=0.3NA;
(3)在a电极通入燃料,为负极,在b电极通入氧气,为正极,正极上O2获得电子,与溶液中的H+结合形成水,正极的电极反应式为O2+4H++4e-=2H2O;电池工作时电流的方向是由正极经外电路到负极,对该电池来说为由b电极到a电极;根据总反应方程式CH3OCH3+3O2=2CO2+3H2O可知:每有1mol CH3OCH3反应,转移12mol电子,则若有0.1mol二甲醚被氧化时,有1.2mol电子发生转移。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

反应过程如图所示,其中只有3条曲线是正确的。请回答:
(1)A点处,v(正)____v(逆) (填“大于”“小于”或“等于”,下同),A点正反应速率_______B点正反应速率。
(2)图中表示NO2的变化的曲线是___。用O2表示从0~2 s内该反应的平均速率v=__。
(3)能说明该反应已经达到平衡状态的是________ (填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________(填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.减小O2的浓度 d.选择高效的催化剂