题目内容
【题目】对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
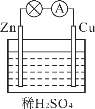
①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn极:Zn-2e-= Zn2+ ④Cu极:Cu2++2e-= Cu
A. ①②B. ①③C. ①②③D. ①②③④
【答案】C
【解析】
锌、铜和稀硫酸组成的原电池中,活泼性较强的锌为原电池的负极,电极反应式为:Zn-2e-=Zn2+,铜为正极,电极反应式为2H++2e-=H2↑,据此分析解答。
①锌、铜和稀硫酸组成的原电池中,活泼性较强的锌为原电池的负极,故①正确;
②原电池工作时,电子由负极经外电路流向正极,即电子由Zn经外电路流向Cu,故②正确;
③锌为原电池的负极,电极反应式为:Zn-2e-=Zn2+,故③正确;
④铜为正极,电极反应式为2H++2e-=H2↑,故④错误;
正确的有①②③,故选C。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
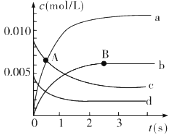
反应过程如图所示,其中只有3条曲线是正确的。请回答:
(1)A点处,v(正)____v(逆) (填“大于”“小于”或“等于”,下同),A点正反应速率_______B点正反应速率。
(2)图中表示NO2的变化的曲线是___。用O2表示从0~2 s内该反应的平均速率v=__。
(3)能说明该反应已经达到平衡状态的是________ (填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________(填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.减小O2的浓度 d.选择高效的催化剂