题目内容
17.密闭容器中的可逆反应 H2(g)+I2(g)?2HI (g),能说明反应达到平衡的是( )| A. | 容器内压强不变 | |
| B. | 单位时间内消耗1molH2,同时生成2molHI | |
| C. | 混合气体的颜色不变 | |
| D. | HI的浓度与I2的浓度相等 |
分析 该反应的正反应是一个反应前后气体体积不变的放热反应,该反应达到平衡状态时正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.该反应前后气体计量数之和不变,所以该反应是否达到平衡状态,其容器内压强始终不变,所以不能根据压强判断平衡状态,故A错误;
B.无论该反应是否达到平衡状态,都存在单位时间内消耗1molH2、同时生成2molHI,所以不能据此判断平衡状态,故B错误;
C.混合气体的颜色不变时,说明碘浓度不变,则该反应中正逆反应速率相等,达到平衡状态,故C正确;
D.HI的浓度与I2的浓度相等时该反应不一定达到平衡状态,与加入反应物浓度及转化为有关,所以不能据此判断平衡状态,故D错误;
故选C.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为判断平衡状态依据,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 64 g SO2含有氧原子数为NA | |
| B. | 1 mol铁与足量稀盐酸反应转移的电子数目为3 NA | |
| C. | 在同温同压下,相同体积的任何气体单质应含有相同的原子数 | |
| D. | 常温常压下,14 g N2含有分子数为0.5 NA |
8.在FeCl3溶液中,加入过量的铜粉,充分反应后,溶液中一定不存在的金属离子是( )
| A. | Fe2+和Cu2+ | B. | Fe3+ | C. | Cu2+ | D. | Fe2+ |
5.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命.二甘醇的结构简式是HO-CH2CH2-O-CH2CH2-OH.下列有关二甘醇的叙述正确的是( )
| A. | 不能发生消去反应 | B. | 能氧化为酮 | ||
| C. | 能与Na反应 | D. | 不能发生取代反应 |
2.某气态烃对氢气的相对密度为2,在氧气中完全燃烧1.16g这种烃,并将所得产物通过装有无水CaCl2的干燥管和装有碱石灰的干燥管,当称量这两个干燥管的质量时,它们依次增重1.8g和3.52g.该烃的分子式为( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
9.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 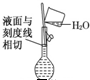 配制溶液 配制溶液 | B. | 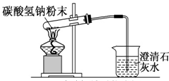 碳酸氢钠受热分解 碳酸氢钠受热分解 | ||
| C. | 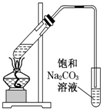 制备乙酸乙酯 | D. | 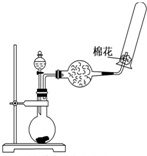 制备收集干燥的氨气 |
6.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后生成NA个胶体粒子 | |
| B. | 在MnO2的作用下,1mol H2O2充分反应转移2NA个电子 | |
| C. | 在标准状况下,22.4L H2和4g He均含有NA个分子 | |
| D. | 46g NO2与92g N2O4均含有3NA个原子 |

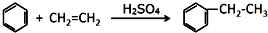
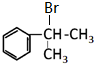 .
.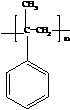 .
. ;
; ,其一氯代物有4种.
,其一氯代物有4种.