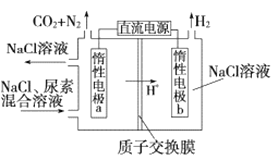
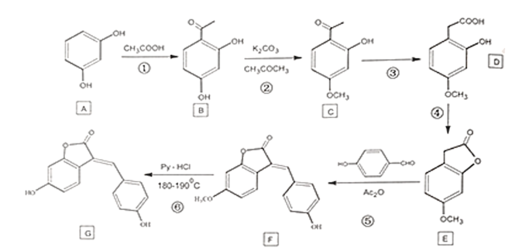
题目内容
【题目】(1)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2g SiH4自燃放出热量89.2kJ,其热化学方程式为:_______
(2)已知60g C(s)与高温水蒸气反应制取CO和H2时吸收657.5kJ热量,写出热化学方程式_____________。
(3)某次发射火箭,用气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g)=2NO2(g) ΔH1=+67.2kJ/mol
② N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-534kJ/mol,
假如都在相同状态下,请写出发射火箭反应的热化学方程式。_______。
(4)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:
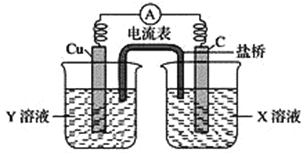
①写出正极电极反应式:___________;
②图中X溶液是_______,铜电极发生___________反应(填“氧化”或“还原”)。
③盐桥中的_____(填“阳”、“阴”)离子向X溶液方向移动。
【答案】SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1 C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ·mol-1 2N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l) ΔH=-1135.2kJ·mol-1 Fe3++e-=Fe2+ FeCl3 氧化 阳
【解析】
(1)首先根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,再书写热化学方程式;
(2)首先计算60gC的物质的量,再计算1mol碳与水蒸气反应吸收的热量,最后书写热化学方程式;
(3)根据盖斯定律计算所需要的热化学方程式;
(4)Cu+2FeCl3=CuCl2+2FeCl2中Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极,C为正极,FeCl3溶液为电解质溶液,据此分析解答。
(1)n(SiH4)=![]() =
=![]() mol,则1molSiH4燃烧放出的热量为:44.6kJ×32=1427.2kJ,热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+H2O(l) △H=-1427.2kJ/mol,故答案为:SiH4(g)+O2(g)=SiO2(g)+H2O(l) △H=-1427.2kJ/mol;
mol,则1molSiH4燃烧放出的热量为:44.6kJ×32=1427.2kJ,热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+H2O(l) △H=-1427.2kJ/mol,故答案为:SiH4(g)+O2(g)=SiO2(g)+H2O(l) △H=-1427.2kJ/mol;
(2)60g C(s)的物质的量为![]() =5mol,5mol碳与适量水蒸气反应生成CO和H2,需吸收657.5kJ热量,则1mol碳与水蒸气反应吸收热量
=5mol,5mol碳与适量水蒸气反应生成CO和H2,需吸收657.5kJ热量,则1mol碳与水蒸气反应吸收热量![]() =131.5kJ,则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJmol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJmol-1;
=131.5kJ,则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJmol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJmol-1;
(3)①N2(g)+2O2(g)═2NO2(g)△H1=+67.2kJ/mol,②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H2=-534kJ/mol,由盖斯定律②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.2kJ/mol,故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.2kJ/mol;
(4)①C为正极,发生还原反应,电极方程式为2Fe3++2e-=2Fe2+,故答案为:2Fe3++2e-=2Fe2+;
②Cu+2FeCl3=CuCl2+2FeCl2中铜被氧化,发生氧化反应,为原电池负极,由装置图可知,Y是氯化铜溶液,则X溶液是FeCl3,故答案为:FeCl3;氧化;
③铜为负极,C为正极,则X是正极池,Y为负极池,原电池工作时,盐桥中的阳离子向X溶液方向移动,故答案为:阳。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸
(2)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)配制上述500mL“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、_____________、__________。(在横线上填写所缺仪器的名称)
(4)鲜花保鲜剂中K+(蔗糖、阿司匹林中不含K+) 的物质的量浓度为______mol/L。