题目内容
8.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料.下列实验事实与硝酸性质不相对应的一组是( )| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--不稳定性 | |
| D. | 稀硝酸能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
分析 A.浓硝酸为酸,且具有强氧化性;
B.稀硝酸具有强氧化性;
C.浓硝酸见光分解;
D.硝酸与NaOH发生中和反应.
解答 解:A.浓硝酸为酸,且具有强氧化性,则浓硝酸使紫色石蕊试液先变红体现酸性后褪色体现强氧化性漂白,故A正确;
B.稀硝酸具有强氧化性,则不能用稀硝酸与锌反应制氢气,二者反应生成硝酸锌、NO和水,故B正确;
C.浓硝酸见光分解,则要用棕色瓶盛装浓硝酸,故C正确;
D.硝酸与NaOH发生中和反应,则使滴有酚酞的氢氧化钠溶液红色褪去,与酸性有关,而与强氧化性无关,故D错误;
故选D.
点评 本题考查硝酸的化学性质,为高频考点,把握性质与发生的化学反应为解答的关键,注重基础知识的考查,注意现象与结论的判断,题目难度不大.

练习册系列答案
相关题目
18.下列分子中的所有碳原子不可能处在同一平面上的是( )
① ②
② ③
③ ④
④ ⑤
⑤
①
 ②
② ③
③ ④
④ ⑤
⑤
| A. | ①⑤ | B. | ①④ | C. | ②④ | D. | ②③ |
19.试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是( )
| A. | 加热,将湿润的红色石蕊试纸放在管口 | |
| B. | 加氢氧化钠溶液,加热,将湿润的酚酞试纸放在管口 | |
| C. | 加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 |
16.已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w g R原子完全转化为R2-时,含有电子的物质的量是( )
| A. | $\frac{m-n-2}{w•m}$ mol | B. | $\frac{w(m-n)}{m}$ mol | C. | w($\frac{m-n-2}{m}$) mol | D. | w($\frac{m-n+2}{m}$) mol |
3.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 锂可用于制造质量轻、电容量大的可充电电池 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 太阳能电池板中有高纯硅单质,光导纤维的主要成分是二氧化硅 |
13.下列离子方程式正确的是( )
| A. | 实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O |
20.密闭容器中可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
| A. | H2、I2、HI的浓度相等 | B. | H2、I2、HI的浓度保持不变 | ||
| C. | 混合气体的密度保持不变 | D. | 混合气体的压强不再改变 |
17.下列各组物质中,前者为附着在容器内壁的污物,后者能除去前者的药品是( )
①银镜-硝酸
②油脂-热Na2CO3溶液
③水垢-醋酸
④硫黄-CS2
⑤苯酚-酒精.
①银镜-硝酸
②油脂-热Na2CO3溶液
③水垢-醋酸
④硫黄-CS2
⑤苯酚-酒精.
| A. | 只有①③⑤ | B. | 只有①④⑤ | C. | 只有②③⑤ | D. | 全部 |
18.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.
下表列出了①~⑩十种元素在周期表中的位置:
请回答下列问题:
(1)十种元素中化学性质最不活泼的是He(填元素符号 ).
(2)在②、③、④三种元素的氧化物对应的水化物中,碱性最强 的是NaOH(填化学式 ),其中含有化学键的类型有离子键、共价键.
(3)元素①、②、⑤原子半径由大到小的顺序为K>Na>H(填元素符号 ).
(4)元素⑦、⑧、⑨氢化物的稳定性由强到弱的顺序为HF>HCl>HBr(填化学式 ).
(5)十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为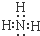 .
.
(6)十种元素中Al(填元素符号 )的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)十种元素中化学性质最不活泼的是He(填元素符号 ).
(2)在②、③、④三种元素的氧化物对应的水化物中,碱性最强 的是NaOH(填化学式 ),其中含有化学键的类型有离子键、共价键.
(3)元素①、②、⑤原子半径由大到小的顺序为K>Na>H(填元素符号 ).
(4)元素⑦、⑧、⑨氢化物的稳定性由强到弱的顺序为HF>HCl>HBr(填化学式 ).
(5)十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为
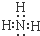 .
.(6)十种元素中Al(填元素符号 )的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.