题目内容
3.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )| A. | 锂可用于制造质量轻、电容量大的可充电电池 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 太阳能电池板中有高纯硅单质,光导纤维的主要成分是二氧化硅 |
分析 A.锂质量轻,常用作可充电电池;
B.“地沟油”的成分是油脂;
C.铁粉是抗氧化剂;
D.太阳能电池板的原料是硅单质,光导纤维的主要成分是二氧化硅.
解答 解:A.锂质量轻,是一种活泼金属,常用作可充电电池,故A正确;
B.“地沟油”的成分是油脂,可用来制肥皂和生物柴油,故B正确;
C.铁粉是抗氧化剂,不是干燥剂,故C错误;
D.太阳能电池板的成分是硅单质,光导纤维的主要成分是二氧化硅,故D正确.
故选:C.
点评 本题考查可充电电池、地沟油的成分、干燥剂、硅和二氧化硅的用途,题目难度不大,注意铁粉是抗氧化剂,不是干燥剂.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列离子方程式不能解释对应实验事实的是( )
| A. | 向小苏打溶液滴加少量盐酸:HCO3-+H+═+H2O+CO2↑ | |
| B. | 用漂白液吸收过量SO2:SO2+H2O+ClO-=2H++SO42-+Cl- | |
| C. | 将少量乙烯气体通入酸性KMnO4溶液:CH2=CH2+4H++MnO4-═C2O42-+Mn2++4H2O | |
| D. | 将铜丝插入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
14.下列关于浓硝酸和浓硫酸的叙述,正确的是( )
| A. | 常温下都用铜容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都降低 |
18.反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1.对此反应速率的表示,正确的是( )
| A. | 用A表示的反应速率是0.4mol•(L•min)-1 | |
| B. | 在2min末的反应速率,用B表示是0.3mol•(L•min)-1 | |
| C. | 分别用B、C、D表示反应的速率,其比是3:2:1 | |
| D. | 在这2min内用B和C表示的反应速率的值都是逐渐减小的 |
8.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料.下列实验事实与硝酸性质不相对应的一组是( )
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--不稳定性 | |
| D. | 稀硝酸能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
15.有机物A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)用结构简式表示A中含有的官能团: -COOH、-OH. |
(4)A的核磁共振氢谱如下图: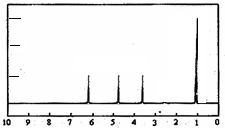 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式  . . | |
12.某有机物的结构简式为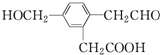 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去.
 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去.
| A. | ②③④ | B. | ①③④⑤⑥ | C. | ①③④⑤ | D. | ①③⑤⑥ |
13.下列叙述中能肯定说明金属A比金属B的活泼的是( )
| A. | A原子电子层数比B原子的电子层数多 | |
| B. | 常温时,A能从稀酸中置换出氢,而B不能 | |
| C. | A原子最外层电子数比B原子的最外层电子数少 | |
| D. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 |
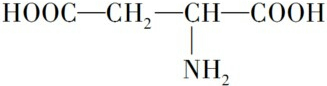 ;B的结构简式为:
;B的结构简式为: .
.