题目内容
pH相等的氨水和氢氧化钠溶液,分别用蒸馏水稀释相同倍数后,两溶液pH的关系是( )
| A、前者大 | B、后者大 |
| C、相等 | D、无法比较 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:一水合氨是弱电解质,溶液中存在电离平衡,加水稀释后一水合氨的电离程度增大,溶液中氢氧根离子物质的量增大;氢氧化钠为强电解质,溶液中完全电离,加水稀释后氢氧根离子物质的量基本不变.
解答:
解:一水合氨是弱电解质,溶液中存在电离平衡,加水稀释后一水合氨的电离程度增大,溶液中氢氧根离子物质的量增大;氢氧化钠为强电解质,溶液中完全电离,加水稀释后氢氧根离子物质的量基本不变,根据c=
可知,二者稀释相同的倍数后,氨水中氢氧根离子浓度大于氢氧化钠中氢氧根离子浓度,氢氧根离子浓度越大,则pH越大,所以氨水中pH大,
故选A.
| n |
| V |
故选A.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,根据氢氧化钠和一水合氨电离程度来分析解答即可,难度不大.

练习册系列答案
相关题目
下列分散系中分散质粒子既能透过滤纸,又能透过半透膜的是( )
| A、豆浆 | B、墨水 | C、泥水 | D、苏打水 |
下列关于卤素单质的叙述,不正确的是( )
| A、单质的颜色随核电荷数的增加逐渐变深 |
| B、随核电荷数的增加单质的氧化性逐渐增强 |
| C、随核电荷数的增加气态氢化物的稳定性逐渐减弱 |
| D、单质的熔沸点随核电荷数的增加逐渐升高 |
用NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
| A、2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA | ||
B、1mol Na2CO3晶体中含CO
| ||
| C、常温常压下,92g的NO2和N2O4混合气体中含有原子数为6NA | ||
| D、惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2L |
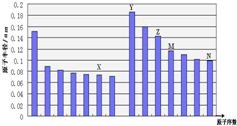 如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )
如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )| A、N、Z两种元素的离子半径相比前者较大 |
| B、M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C、X与M两种元素组成的化合物能与水反应生成相应的酸 |
| D、工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |
在下列溶液中,各组离子一定能够大量共存的是( )
| A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、K+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-? |
| C、pH=12的溶液:K+、Mg2+、Cl-、Br- |
| D、碳酸氢钠溶液:K+、SO32-、Cl-、H+ |
A2、B2、C2三种单质和它们的离子间能发生如下反应:
①2A-+C2→2C-+A2;
②2C-+B2→2B-+C2;
③2X-+C2→2C-+X2;
则下列判断中错误的是( )
①2A-+C2→2C-+A2;
②2C-+B2→2B-+C2;
③2X-+C2→2C-+X2;
则下列判断中错误的是( )
| A、氧化性最强:B2 |
| B、还原性最强:X- |
| C、X2与B-一定不能发生反应 |
| D、X2与A-一定不能发生反应 |