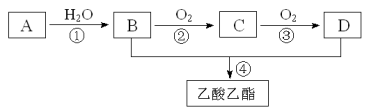
题目内容
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是
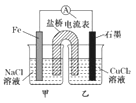
A.原电池的总反应为 Fe+Cu2+=Fe2++Cu
B.反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D.盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
【答案】D
【解析】
试题分析:A.负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-=Cu,则原电池的总反应为Fe+Cu2+═Fe2++Cu,故A正确;B.Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
12g n
解得:n=0.2mol,故B正确;C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,溶液中的氢离子在正极上得电子,则石墨电极反应式为2H++2e-═H2↑,故C正确;D.盐桥中是KNO3溶液,则盐桥中NO3-移向负极移动,即向甲烧杯,故D错误;故选D。

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目