题目内容
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
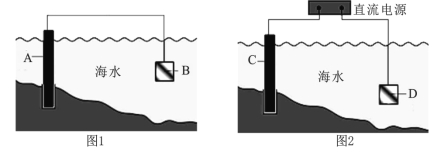
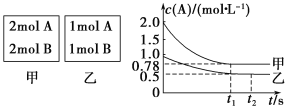
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择 (填字母序号)。
a.碳棒 b.锌板 c.铜板
该电化学保护方法的名称是 。
(2)图2中,钢闸门C为 极,用氯化钠溶液模拟海水进行实验,D为石墨块,总反应的离子方程式为 。
(3)有关上述实验,下列说法正确的是 。
A.溶液中Na+向D极移动
B.从D极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(4)模拟工业上离子交换膜法制烧碱的方法,可用如图装置电解硫酸钾溶液来制取H2、O2、H2SO4和KOH。
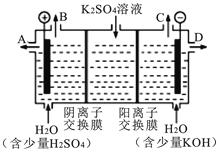
①该电解槽的阳极反应方程式为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”) 导出。
③若采用CH4燃料电池(石墨为电极,KOH为电解质溶液)为电源,则该电池的负极电极方程式为 ,若B极产生标准状况下22.4 L气体,则理论上需要通入 mol CH4。
④电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
【答案】(1)b 牺牲阳极的阴极保护法
(2)阴 2Cl-+2H2O ![]() 2OH-+ H2↑+ Cl2↑(2分) (3)B
2OH-+ H2↑+ Cl2↑(2分) (3)B
(4)①2H2O-4e- = 4H+ + O2↑或4OH--4e- =O2↑+2H2O(2分) ;小于; ②D;
③CH4-8e- +10OH-= CO32- +7H2O(2分) ;0.5
④H2O![]() H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+)(2分)
H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+)(2分)
【解析】
试题分析:(1)形成原电池时,Fe作正极被保护,则要选择活泼性比Fe强的金属作负极,所以选锌;该电化学保护方法叫做牺牲阳极的阴极保护法;
(2)Fe作阴极被保护,则钢闸门C做阴极;电解氯化钠溶液时阳极上氯离子失电子生成氯气,其电极总反应式为2Cl-+2H2O ![]() 2OH-+ H2↑+ Cl2↑;
2OH-+ H2↑+ Cl2↑;
(3)A.电解池中阳离子向阴极移动,则溶液中Na+向C极移动,故A错误;B.D极为阳极,逸出的气体为氯气,能使湿润的KI淀粉试纸变蓝,故B正确;C.电解氯化钠溶液生成氢气、氯气和NaOH溶液,则反应一段时间后通适量HCl气体可恢复到电解前电解质的浓度,故C错误;答案为B。
(4)①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;
②氢氧化钾在阴极生成,所以在D口导出;
③在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,其中负极电极反应是CH4-8e-+10OH-═CO32-+7H2O;B极产生的气体为氧气,标准状况体积为22.4L,物质的量为1mol,转移电子为4mol,则消耗甲烷的物质的量为4mol÷8=0.5mol;
④通电开始后,阴极上氢离子放电生成氢气,氢离子来自于水,所以促进水的电离平衡向正方向移动,导致溶液中氢氧根离子的浓度大于氢离子的浓度,所以溶液的PH值增大。