题目内容
12.8g铜片与50mL某浓度的硝酸恰好完全反应,生成硝酸铜和NO、NO2混合气体,且收集到的混合气体在标准状况下体积为4.48L; 请计算:(在下面写出计算过程)
(1)被还原的硝酸的物质的量为 mol.
(2)求原硝酸的物质的量浓度.
(1)被还原的硝酸的物质的量为
(2)求原硝酸的物质的量浓度.
考点:化学方程式的有关计算
专题:计算题
分析:n(Cu)=
=0.2mol,铜与浓硝酸反应生成NO2,随着反应的进行,硝酸的浓度逐渐降低,稀硝酸与铜反应生成NO,NO2、NO的物质的量共为
=0.2mol,被还原的硝酸的物质的量等于生成NO2、NO的总的物质的量,硝酸反应后生成硝酸铜、NO和NO2,根据N原子守恒可计算硝酸的物质的量浓度,
| 12.8g |
| 64g/mol |
| 4.48L |
| 22.4L/mol |
解答:
解:(1)NO2、NO的物质的量共为
=0.2mol,被还原的硝酸的物质的量等于生成NO2、NO的总的物质的量,为0.2mol,故答案为:0.2;
(2)n(Cu)=
=0.2mol,反应后生成Cu(NO3)2、NO和NO2,且NO和NO2的物质的量总共为
=0.2mol,则反应中消耗HNO3的物质的量为2n(Cu(NO3)2)+n(NO)+n(NO2)=2×0.2mol+0.2mol=0.6mol,所以原硝酸的物质的量浓度为
=12mol/L,
答:原硝酸的物质的量浓度12mol/L.
| 4.48L |
| 22.4L/mol |
(2)n(Cu)=
| 12.8g |
| 64g/mol |
| 4.48L |
| 22.4L/mol |
| 0.6mol |
| 0.05L |
答:原硝酸的物质的量浓度12mol/L.
点评:本题考查化学方程式的计算,注意把握硝酸的性质,解答本题的关键是把握氧化还原反应的特点,答题时注意从守恒的角度入手思考.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
下列有关化学反应速率的说法中,正确的是( )
| A、100mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B、用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C、二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
| D、汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
欲从苯酚的乙醇溶液中分离苯酚和乙醇,有下列操作:
①过滤 ②蒸馏 ③静置分液 ④加入足量的金属钠 ⑤加入足量的NaOH溶液 ⑥通入过量的二氧化碳 ⑦加入足量的FeCl3溶液 ⑧加入乙酸与浓硫酸混合液加热.
合理的实验操作步骤及顺序是( )
①过滤 ②蒸馏 ③静置分液 ④加入足量的金属钠 ⑤加入足量的NaOH溶液 ⑥通入过量的二氧化碳 ⑦加入足量的FeCl3溶液 ⑧加入乙酸与浓硫酸混合液加热.
合理的实验操作步骤及顺序是( )
| A、④⑤③ | B、⑥①⑤③ |
| C、⑧①⑦③ | D、⑤②⑥③ |
下列说法正确的是( )
| A、32g O2占有的体积约为22.4L |
| B、22g二氧化碳与标准状况下11.2L HCl含有相同的分子数 |
| C、标准状况下,22.4L水的质量约为18g |
| D、22.4L N2含有阿伏加德罗常数个N2 |
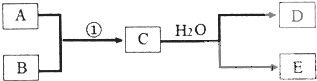 已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系:
已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系:
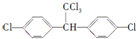 的有机物中,分子中最多有
的有机物中,分子中最多有