题目内容
用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2+3H2
2NH3.已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ.
(1)请写出该反应的热化学方程式 .
(2)如果一个反应的△H-T△S<0,则该反应能够自发进行.已知该反应的△S=-198.2J?K-1?mol-1.则上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行.
| 高温、高压 |
| 催化剂 |
(1)请写出该反应的热化学方程式
(2)如果一个反应的△H-T△S<0,则该反应能够自发进行.已知该反应的△S=-198.2J?K-1?mol-1.则上述氨气的合成反应在常温下
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ,计算6g氢气反应放热92.4KJ,标注物质聚集状态和对应反应焓变书写热化学方程式;
(2)依据焓变、熵变、温度计算△H-T△S,依据△H-T△S<0判断反应自发进行.
(2)依据焓变、熵变、温度计算△H-T△S,依据△H-T△S<0判断反应自发进行.
解答:
解:(1)在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ,6g氢气反应放热92.4KJ,反应的热化学方程式为:N2(g)+3H2 (g)=2NH3(g)△H=-92.4KJ/mol;
故答案为:N2(g)+3H2 (g)=2NH3(g)△H=-92.4KJ/mol;
(2)已知该反应的△S=-198.2J?K-1?mol-1,△H=-92.4KJ/mol,则△H-T△S=-92.4KJ/mol-298K×(-198.2×10-3KJ?K-1′mol-1)=-33.3KJ/mol<0,则上述反应在常温下能自发进行;
故答案为:能.
故答案为:N2(g)+3H2 (g)=2NH3(g)△H=-92.4KJ/mol;
(2)已知该反应的△S=-198.2J?K-1?mol-1,△H=-92.4KJ/mol,则△H-T△S=-92.4KJ/mol-298K×(-198.2×10-3KJ?K-1′mol-1)=-33.3KJ/mol<0,则上述反应在常温下能自发进行;
故答案为:能.
点评:本题考查了热化学方程式书写,反应自发进行的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列化学事实的描述或解释正确的是( )
| A、电化学腐蚀是造成金属腐蚀的主要原因 |
| B、将可见光通过胶体出现“光路”是因为发生了光的折射 |
| C、有些化学反应既属于复分解反应又属于氧化还原反应 |
| D、铜片放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中发生钝化 |
下列说法正确的是( )
| A、HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性 |
| B、煤的干馏是物理变化,煤的气化和液化是化学变化 |
| C、纤维素、蛋白质、油脂均为天然高分子化合物 |
D、聚碳酸酯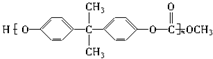 中含有 中含有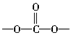 结构 结构 |
C8H16的烯烃各同分异构体中,其中与HBr发生加成反应只生成一种产物的有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
 ;②
;②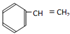 ;③
;③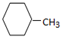 ;④
;④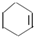 ;⑤
;⑤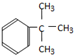 ;⑥
;⑥