��Ŀ����
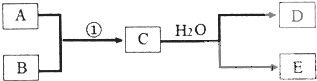 ��֪����A��B��C��D��E���ɶ�����Ԫ�ع��ɵĵ��ʻ�����ǿɷ�����ͼ��ʾ��ת����ϵ��
��֪����A��B��C��D��E���ɶ�����Ԫ�ع��ɵĵ��ʻ�����ǿɷ�����ͼ��ʾ��ת����ϵ����1����������Ϊ��ȼ��Ŀǰ60%�Ľ�������B���ǴӺ�ˮ����ȡ�ģ�����D����ʹʪ��ĺ�ɫʯ����ֽ����������D�ĵ���ʽΪ��
��2����������Ϊ���ȣ�E��һ���������������д�������ʵ���ʽ���뷽��ʽ��
��3����������Ϊ���£�B��DΪͬһ����ɫ���壬������E��Ũ��Һ����ʹFe�ۻ���д������Fe����E��Ũ��Һ�ڼ��������·�Ӧ�Ļ�ѧ����ʽ��
���㣺������ƶ�
ר�⣺�ƶ���
��������1����������Ϊ��ȼ��Ŀǰ60%��B���ǴӺ�ˮ����ȡ�ģ���B��Mg������D����ʹʪ��ĺ�ɫʯ����ֽ��������D��NH3��C��ˮ��Ӧ���ɰ�����E������Ԫ���غ�֪��A�к��е�Ԫ�أ�Mg�͵����ܷ������ɵ���þ������A�ǵ���������þ��ˮ��Ӧ���ɰ�����������þ��
��2����������Ϊ���ȣ�E��һ���������������E����������������D��һ���г�������ζ�����壬��ˮ��Һ�ǻ�ԭ���ᣬ��D�����⣬����Ԫ���غ�֪��C��������
��3����������Ϊ���£�B��DΪͬ-����ɫ���壬������E��Ũ��Һ����ʹFe�ۻ�����E�����ᣬD��һ��������C�Ƕ���������A������������Fe�ۺ�Ũ���ᷴӦ����������������������ˮ��
��2����������Ϊ���ȣ�E��һ���������������E����������������D��һ���г�������ζ�����壬��ˮ��Һ�ǻ�ԭ���ᣬ��D�����⣬����Ԫ���غ�֪��C��������
��3����������Ϊ���£�B��DΪͬ-����ɫ���壬������E��Ũ��Һ����ʹFe�ۻ�����E�����ᣬD��һ��������C�Ƕ���������A������������Fe�ۺ�Ũ���ᷴӦ����������������������ˮ��
���
�⣺��1����������Ϊ��ȼ��Ŀǰ60%��B���ǴӺ�ˮ����ȡ�ģ���B��Mg������D����ʹʪ��ĺ�ɫʯ����ֽ��������D��NH3��C��ˮ��Ӧ���ɰ�����E������Ԫ���غ�֪��A�к��е�Ԫ�أ�Mg�͵����ܷ������ɵ���þ������A�ǵ���������þ��ˮ��Ӧ���ɰ�����������þ��
D��NH3��Ϊ���ۻ��������ʽΪ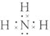 ��������Ϊ���壬��ˮΪҺ�壬�е��ˮ�ĵͣ�CΪMg3N2����Ӧ������Mg2+��N3-��������ͬ�ĺ�������Ų�����˵����Խ�����Ӱ뾶ԽС����N3-��Mg2+��C��H2O��Ӧ�Ļ�ѧ����ʽΪMg3N2+6H2O=3Mg��OH��2+2NH3����
��������Ϊ���壬��ˮΪҺ�壬�е��ˮ�ĵͣ�CΪMg3N2����Ӧ������Mg2+��N3-��������ͬ�ĺ�������Ų�����˵����Խ�����Ӱ뾶ԽС����N3-��Mg2+��C��H2O��Ӧ�Ļ�ѧ����ʽΪMg3N2+6H2O=3Mg��OH��2+2NH3����
�ʴ�Ϊ��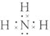 ���ͣ�N3-��Mg2+��Mg3N2+6H2O=3Mg��OH��2+2NH3����
���ͣ�N3-��Mg2+��Mg3N2+6H2O=3Mg��OH��2+2NH3����
��2����������Ϊ���ȣ�E��һ���������������E����������������D��һ���г�������ζ�����壬��ˮ��Һ�ǻ�ԭ���ᣬ��D�����⣬����Ԫ���غ�֪��C����������������Ϊ�������������ʽ���뷽��ʽΪAl��OH��3?AlO2-+H++H2O�������Ƕ�Ԫ�ᣬ�͵����ʵ������������Ʒ�Ӧ�������⻯�ƣ��������ӷ�Ӧ����ʽΪ��H2S+OH-=HS-+H2O����Ӧ�����Һ�ʼ��ԣ�HS-+ˮ����ڵ���̶ȣ�����Ũ�ȴ�С˳��Ϊc��Na+����c��HS-����c��OH-����c��H+����c��S2-����
�ʴ�Ϊ��Al��OH��3?AlO2-+H++H2O��H2S+OH-=HS-+H2O��c��Na+����c��HS-����c��OH-����c��H+����c��S2-����
��3����������Ϊ���£�B��DΪͬ-����ɫ���壬������E��Ũ��Һ����ʹFe�ۻ�����E�����ᣬD��һ��������C�Ƕ���������A������������Fe�ۺ�Ũ���ᷴӦ����������������������ˮ������ʽΪFe+6HNO3��Ũ��
Fe��NO3��3+3NO2��+3H2O��
��״���£���һ����NO2������Թܣ�������ˮ�У���Һ�治������ʱ���ٳ�����������ʹҺ����������������Թܣ����õ������ᣮ���Թ����ΪVL�������Թ���������Һ��Ũ��Ϊ
=0.045mol/L��
�ʴ�Ϊ��Fe+6HNO3��Ũ��
Fe��NO3��3+3NO2��+3H2O��0.045mol/L��
D��NH3��Ϊ���ۻ��������ʽΪ
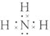 ��������Ϊ���壬��ˮΪҺ�壬�е��ˮ�ĵͣ�CΪMg3N2����Ӧ������Mg2+��N3-��������ͬ�ĺ�������Ų�����˵����Խ�����Ӱ뾶ԽС����N3-��Mg2+��C��H2O��Ӧ�Ļ�ѧ����ʽΪMg3N2+6H2O=3Mg��OH��2+2NH3����
��������Ϊ���壬��ˮΪҺ�壬�е��ˮ�ĵͣ�CΪMg3N2����Ӧ������Mg2+��N3-��������ͬ�ĺ�������Ų�����˵����Խ�����Ӱ뾶ԽС����N3-��Mg2+��C��H2O��Ӧ�Ļ�ѧ����ʽΪMg3N2+6H2O=3Mg��OH��2+2NH3�����ʴ�Ϊ��
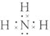 ���ͣ�N3-��Mg2+��Mg3N2+6H2O=3Mg��OH��2+2NH3����
���ͣ�N3-��Mg2+��Mg3N2+6H2O=3Mg��OH��2+2NH3������2����������Ϊ���ȣ�E��һ���������������E����������������D��һ���г�������ζ�����壬��ˮ��Һ�ǻ�ԭ���ᣬ��D�����⣬����Ԫ���غ�֪��C����������������Ϊ�������������ʽ���뷽��ʽΪAl��OH��3?AlO2-+H++H2O�������Ƕ�Ԫ�ᣬ�͵����ʵ������������Ʒ�Ӧ�������⻯�ƣ��������ӷ�Ӧ����ʽΪ��H2S+OH-=HS-+H2O����Ӧ�����Һ�ʼ��ԣ�HS-+ˮ����ڵ���̶ȣ�����Ũ�ȴ�С˳��Ϊc��Na+����c��HS-����c��OH-����c��H+����c��S2-����
�ʴ�Ϊ��Al��OH��3?AlO2-+H++H2O��H2S+OH-=HS-+H2O��c��Na+����c��HS-����c��OH-����c��H+����c��S2-����
��3����������Ϊ���£�B��DΪͬ-����ɫ���壬������E��Ũ��Һ����ʹFe�ۻ�����E�����ᣬD��һ��������C�Ƕ���������A������������Fe�ۺ�Ũ���ᷴӦ����������������������ˮ������ʽΪFe+6HNO3��Ũ��
| ||
��״���£���һ����NO2������Թܣ�������ˮ�У���Һ�治������ʱ���ٳ�����������ʹҺ����������������Թܣ����õ������ᣮ���Թ����ΪVL�������Թ���������Һ��Ũ��Ϊ
| ||
| VL |
�ʴ�Ϊ��Fe+6HNO3��Ũ��
| ||
���������⿼��������ƶϣ�Ϊ�߿��������ͣ�������ѧ���ķ��������ͼ��������Ŀ��飬ע����ȷ�ƶ������ǽⱾ��ؼ�����ȷ���ʵ��������ʼ��ɽ���Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
NA��ʾ�����ӵ��������й�NA����ȷ˵���ǣ�������
| A��1mol D318O+�к��е�������Ϊ10NA |
| B����״���£�22.4Lˮ�к�O-H����Ϊ2NA |
| C��ij�¶�ʱ1L pH=6�Ĵ�ˮ����OH-������Ϊ1.0��10-6NA |
| D��7.8g Na2S��Na2O2�Ļ�����к��е�������������0.1NA |
�����Լ������ò���ƿʢ�ŵ��ǣ�������
| A��NaOH��Һ | B������� |
| C��NaCl��Һ | D��ϡ���� |
�������ʵ����ʱȽϣ�����ȷ���ǣ�������
| A�����ԣ�H2SO4��HClO4��HBrO4 |
| B�����ԣ�RbOH��KOH��NaOH |
| C���ǽ����ԣ�Cl��S��P |
| D����̬�⻯���ȶ��ԣ�HF��HCl��HBr |
 ����
���� ����
���� ����
���� ����
���� ����
����