题目内容
某元素的核素
X,其氯化物XCl2 111mg溶于水后,加入0.1mol/L的硝酸银溶液20mL,恰好将其中的Cl-完全沉淀.已知该核素中的质子数和中子数相等.试通过计算回答下列问题:
(1)核素X的质量数为 ,该原子结构示意图为 ;(请在下面写出计算过程)
(2)用电子式表示出XCl2的形成过程 .
A Z |
(1)核素X的质量数为
(2)用电子式表示出XCl2的形成过程
考点:质量数与质子数、中子数之间的相互关系,用电子式表示简单的离子化合物和共价化合物的形成
专题:原子组成与结构专题
分析:由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×0.1mol/L=0.002mol,则n(XCl2)=
n(Cl-)=
×0.002mol=0.001mol,则M(XCl2)=
=111g/mol,所以XCl2相对分子质量为111,故X的相对原子质量=111-35.5×2=40,即X的质量数为40,X的质子数=质量数-中子数=40-20=20,故X为Ca元素,据此解答.
| 1 |
| 2 |
| 1 |
| 2 |
| 0.111g |
| 0.001mol |
解答:
解:由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×0.1mol/L=0.002mol,则n(XCl2)=
n(Cl-)=
×0.002mol=0.001mol,则M(XCl2)=
=111g/mol,所以XCl2相对分子质量为111,故X的相对原子质量=111-35.5×2=40,即X的质量数为40,X的质子数=质量数-中子数=40-20=20,故X为Ca元素,其原子结构示意图为: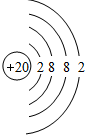 ,
,
故答案为:20; ;
;
(2)CaCl2属于离子化合物,用电子式表示CaCl2的形成过程为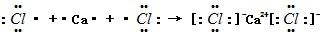 ,
,
故答案为: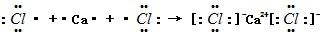 ;
;
| 1 |
| 2 |
| 1 |
| 2 |
| 0.111g |
| 0.001mol |
 ,
,故答案为:20;
 ;
;(2)CaCl2属于离子化合物,用电子式表示CaCl2的形成过程为
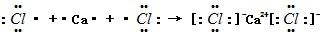 ,
,故答案为:
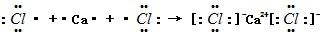 ;
;
点评:本题考查离子方程式的计算、结构性质位置关系应用、常用化学用语等,难度不大,注意掌握用电子式表示化学键或物质的形成过程.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
下列对Na2O2的叙述中,正确的是( )
| A、Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
| B、Na2O2中氧元素的化合价为-2价 |
| C、Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2 |
| D、Na2O2需要密封保存 |
下列操作达不到预期目的是( )
①石油分馏时把温度计水银球插入受热的液体中;
②用酸性高锰酸钾溶液除去乙炔中含有的H2S;
③用溴乙烷在NaOH溶液中加热后,加入AgNO3溶液检验卤素原子;
④将苯和溴水混合后加入铁粉制取溴苯;
⑤将敞口久置的电石与蒸馏水混合制取乙炔.
①石油分馏时把温度计水银球插入受热的液体中;
②用酸性高锰酸钾溶液除去乙炔中含有的H2S;
③用溴乙烷在NaOH溶液中加热后,加入AgNO3溶液检验卤素原子;
④将苯和溴水混合后加入铁粉制取溴苯;
⑤将敞口久置的电石与蒸馏水混合制取乙炔.
| A、①⑤ | B、③④⑤ |
| C、①②③⑤ | D、①②③④⑤ |
把质量为m g的铜丝灼烧变黑,立即放入下列物质中,使铜丝变红,而且质量仍为m g的是( )
①稀硫酸 ②C2H5OH ③稀硝酸 ④CO.
①稀硫酸 ②C2H5OH ③稀硝酸 ④CO.
| A、①② | B、②④ | C、③④ | D、②③ |
已知卤代烃可与金属钠反应,生成碳链较长的烃:R-X+2Na+R′-X→R-R′+2NaX:现有碘乙烷和碘丙烷的混合物,使其与金属钠反应,不可能生成的烃是( )
| A、戊烷 | B、丁烷 |
| C、己烷 | D、2-甲基己烷 |
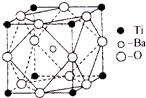 在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是
在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是