题目内容
Ⅰ、2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
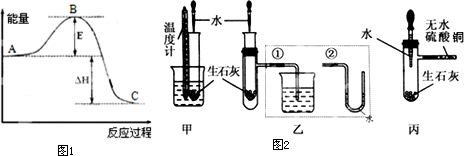
(1)图1中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? (填“有”或“无”).
(2)2SO2(g)+O2(g)=2SO3(g)△H= kJ?mol-1
Ⅱ、某化学小组对生石灰与水反应是显著放热反应进行了实验探究,如图2,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案.
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是(写一点即可) ,说明反应放热.(下列装置中支撑及捆绑等仪器已略去)
乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是
(接①) ,
(接②) ,
说明反应放热.
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是 ,说明反应放热.

(1)图1中A、C分别表示
(2)2SO2(g)+O2(g)=2SO3(g)△H=
Ⅱ、某化学小组对生石灰与水反应是显著放热反应进行了实验探究,如图2,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案.
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是(写一点即可)
乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是
(接①)
(接②)
说明反应放热.
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是
考点:反应热和焓变,探究吸热反应和放热反应
专题:实验设计题
分析:(1)根据A、C分别表示反应物总能量和生成物总能量;活化能的大小与反应热无关;
(2)根据反应2SO2(g)+O2(g)=2SO3(g)结合1molSO2(g)氧化为1molSO3的△H=-99kJ?mol-1计算反应热;
(3)甲方案:氧化钙可以和水反应生成氢氧化钙,反应会产生大量的热;
方案乙:气体具有热胀冷缩的性质,利用大气压强原理来解答;
丙方案:根据无色硫酸铜遇到水生成蓝色硫酸铜晶体进行解答;
(2)根据反应2SO2(g)+O2(g)=2SO3(g)结合1molSO2(g)氧化为1molSO3的△H=-99kJ?mol-1计算反应热;
(3)甲方案:氧化钙可以和水反应生成氢氧化钙,反应会产生大量的热;
方案乙:气体具有热胀冷缩的性质,利用大气压强原理来解答;
丙方案:根据无色硫酸铜遇到水生成蓝色硫酸铜晶体进行解答;
解答:
解:(1)图中A、C分别表示反应物总能量、生成物总能量;B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,反应反应热不变;
故答案为:反应物能量;生成物能量;无;
(2)1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1;
故答案为:-198;
(3)方案甲:胶头滴管向小试管中缓缓滴入水,氧化钙可以和水反应生成氢氧化钙,会看到小试管中固体变成乳状,同时有大量水蒸气产生,温度计温度上升;
故答案为:小试管中固体变成乳状,同时有大量水蒸气产生,同时温度计温度上升;
方案乙:①氧化钙可以和水反应生成氢氧化钙,反应会产生大量的热,导致带支管的试管中气压增大,所以会看到乙中接①的烧杯中有气泡产生,解②的细导管左边水柱下降,右边水柱上升;
故答案为:烧杯中有气泡产生;左边水柱下降,右边水柱上升.
丙方案:生石灰与水反应放出了热量,使水蒸发,无水硫酸铜与水反应生成了蓝色硫酸铜晶体,证明了该反应放热,
故答案为:无水硫酸铜粉末变蓝色;
故答案为:反应物能量;生成物能量;无;
(2)1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1;
故答案为:-198;
(3)方案甲:胶头滴管向小试管中缓缓滴入水,氧化钙可以和水反应生成氢氧化钙,会看到小试管中固体变成乳状,同时有大量水蒸气产生,温度计温度上升;
故答案为:小试管中固体变成乳状,同时有大量水蒸气产生,同时温度计温度上升;
方案乙:①氧化钙可以和水反应生成氢氧化钙,反应会产生大量的热,导致带支管的试管中气压增大,所以会看到乙中接①的烧杯中有气泡产生,解②的细导管左边水柱下降,右边水柱上升;
故答案为:烧杯中有气泡产生;左边水柱下降,右边水柱上升.
丙方案:生石灰与水反应放出了热量,使水蒸发,无水硫酸铜与水反应生成了蓝色硫酸铜晶体,证明了该反应放热,
故答案为:无水硫酸铜粉末变蓝色;
点评:本题综合考查反应热与焓变,化学实验探究,合理地设计了实验探究方案,充分考查了学生的分析、理解能力,本题难度中等.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
下列说法不正确的是( )
| A、金属氧化物都是碱性氧化物 |
| B、盐电离出的离子一定有金属离子 |
| C、由同种元素组成的物质一定是单质 |
| D、非金属氧化物都是酸性氧化物 |
下列关于电解质溶液的叙述正确的是( )
| A、热的纯碱溶液和冷的纯碱溶液洗涤油污效果一样好 |
| B、常温下,将氨水加入到盐酸中,所得溶液中一定存在:c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D、强电解质的水溶液的导电性一定比弱电解质的水溶液强 |
下列化学实验事实及其解释或结论都正确的是( )
| A、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| B、用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯,用饱和的Na2CO3溶液可以洗去其中含有的乙醇和乙酸,说明乙酸乙酯在Na2CO3溶液中的溶解度很小 |
| C、向浓度均为0.1mol?L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| D、配制0.10mol/L NaCl溶液,俯视容量瓶的刻度线定容,所配溶液浓度偏大 |