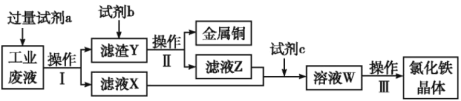
题目内容
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”。引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气。
I、用NH3催化还原NOx可以消除氮氧化物的污染。反应原理为:NO(g)+NO2(g)+2NH3(g) ![]() 2N2(g)+3H2O(g)。
2N2(g)+3H2O(g)。
(1)该反应的△S________0(填“>”、“=”或“<”)。
(2)II、已知反应N2O4(g) ![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
a.气体颜色不再改变b.△H不再改变
c.v正(N2O4)=2v逆(NO2)d.N2O4的转化率不再改变
(3)III、用CH4催化还原NOx也可以消除氮氧化物的污染。
已知:CH4(g)的标准燃烧热为-890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1114 kJ/mol
2NO(g)+O2(g)=2NO2(g)△H=﹣114 kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:________。
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
温度/℃ | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)=________。
②温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将________(填“增大”、“减小”或“不变”)。
【答案】> ad CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-844kJ/mol 0.0125mol/(Lmin) 减小
【解析】
(1)由于反应前后气体分子数增大,因此ΔS>0;
(2)a、气体颜色不再改变时,反应达到平衡状态,透光率不再改变,a符合题意;b、ΔH是表示反应的热效应,只与物质具有能量的相对大小有关,ΔH不变,不能说明反应达到平衡状态,b不符合题意;c、根据反应速率之比等于化学计量系数之比可得,当反应达到平衡状态时,2v正(N2O4)=v逆(NO2),c不符合题意;d、当N2O4的转化率不再改变时,说明反应达到平衡状态,此时透光率不再改变,d符合题意;故答案为ad;
(3)CH4(g)燃烧热的热化学方程式为: ![]() ①,
①,
H2O(l)转化为H2O(g)的热化学方程式为:![]() ②;又已知:
②;又已知:![]() ③,
③,
![]() ④,
④,
①+2×②+③-2×④,得到反应:![]() ,相应的
,相应的![]() ,把方程式的系数和H都除以2,得到CH4催化还原NO2反应的热化学方程式为:
,把方程式的系数和H都除以2,得到CH4催化还原NO2反应的热化学方程式为:![]() 。故答案为:
。故答案为:![]() 。
。
(4)①由表格数据可知,0~20min内,参与反应的n(NO2)=0.5mol,根据反应的化学方程式可知,参与反应的n(CH4)=0.25mol,则0~20min内,用CH4表示的反应速率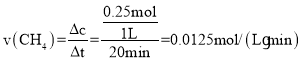 ;故答案为:0.0125mol/(Lmin)。
;故答案为:0.0125mol/(Lmin)。
②达到平衡后,再充入0.5molCH4和1.2molNO2,由于温度和容器的体积均不变,因此反应体系的压强增大,平衡逆向移动,因此CH4的转化率减小,故答案为:减小。