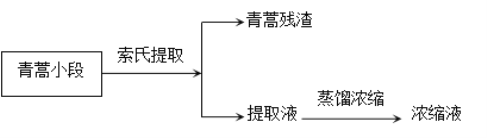
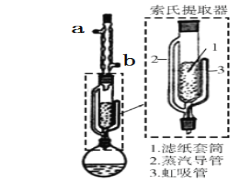
题目内容
【题目】三氯氧磷![]() 广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸
广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸![]() 。请回答下列问题:
。请回答下列问题:
![]() 已知亚磷酸
已知亚磷酸![]() 为二元弱酸,则
为二元弱酸,则![]() 溶液中,各离子浓度的大小关系为________。
溶液中,各离子浓度的大小关系为________。
![]() 常温下,将NaOH溶液滴加到亚磷酸
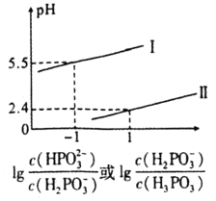
常温下,将NaOH溶液滴加到亚磷酸![]() 溶液中,混合溶液pH与离子浓度变化的关系如图所示。则表示
溶液中,混合溶液pH与离子浓度变化的关系如图所示。则表示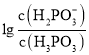 的是曲线________
的是曲线________![]() 填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ”![]() ,亚磷酸
,亚磷酸![]() 的
的![]() ________,反应
________,反应![]() 的平衡常数值是________。
的平衡常数值是________。
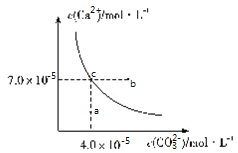
![]() 工业上生产三氯氧磷的同时会产生含磷废水
工业上生产三氯氧磷的同时会产生含磷废水![]() 主要成分为
主要成分为![]() 、
、![]() 。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中
。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中![]() ,则溶液中
,则溶液中![]() ________
________![]() 。
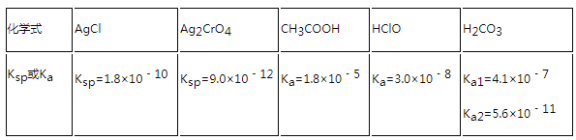
。![]() 已知
已知![]() )
)![]()
【答案】![]() Ⅱ
Ⅱ ![]()
![]()
![]()
【解析】
Ⅰ![]() 亚磷酸
亚磷酸![]() 为二元弱酸,则
为二元弱酸,则![]() 不能再发生电离,只能水解,使溶液呈碱性,同时考虑到水也存在电离平衡,所以溶液中
不能再发生电离,只能水解,使溶液呈碱性,同时考虑到水也存在电离平衡,所以溶液中![]() ,因此溶液中离子浓度大小顺序为:
,因此溶液中离子浓度大小顺序为:![]() ,
,
故答案为:![]() ;
;
![]() 根据
根据![]() 的电离平衡常数,
的电离平衡常数,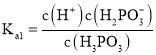 ,
,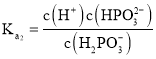 ,则
,则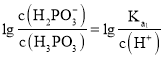 ,
,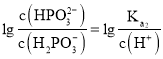 ,所以图像关系可表示为:
,所以图像关系可表示为: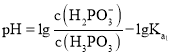 ,
, ,由于
,由于![]() ,
,![]() 相同时,
相同时,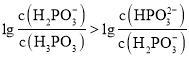 ,根据图像,则表示
,根据图像,则表示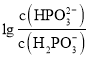 的图线为曲线I,表示
的图线为曲线I,表示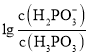 的是曲线Ⅱ;当溶液中
的是曲线Ⅱ;当溶液中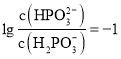 时,
时,![]() ,所以亚磷酸
,所以亚磷酸![]() 的
的
![]() ;当
;当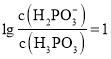 时
时![]() ,亚磷酸
,亚磷酸![]() 的
的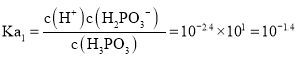 ,所以反应
,所以反应![]() 的平衡常数值是
的平衡常数值是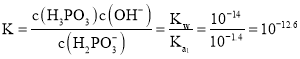 ;
;
故答案为:Ⅱ,![]() ,
,![]() ;
;
![]() 处理后的废水中
处理后的废水中![]() ,则溶液中
,则溶液中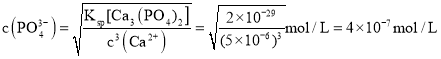 。
。

 阅读快车系列答案
阅读快车系列答案【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) +2H2(g) ![]() CH3OH(g) △H =-90.8 kJ·mol-1
CH3OH(g) △H =-90.8 kJ·mol-1
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
平衡 时 数据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | bkJ | ckJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
A. 2c1>c3 B. ∣a∣+∣b∣=90.8
C. 2p2<p3 D. a1+ a3<1