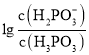题目内容
【题目】下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
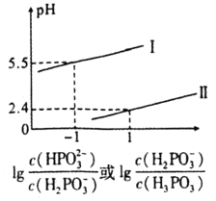
②已知BaSO4的Ksp=c(Ba2+)c(SO42﹣),所以在BaSO4溶液中有c(Ba2+)=c(SO42﹣)=![]()
③将0.1molL﹣1的NaHS和0.1molL﹣1Na2S溶液等体积混合,所得溶液中有c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S)
④在0.1mol/L氨水中滴加0.1mol/L盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10﹣a molL﹣1
A.①④B.②③C.③④D.①②
【答案】C
【解析】
![]() 常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,若a+n<7时,则pH=a+n;但是若a+n7时,溶液稀释后其pH不可能大于7,溶液的pH只能无限接近7,故①错误;
常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,若a+n<7时,则pH=a+n;但是若a+n7时,溶液稀释后其pH不可能大于7,溶液的pH只能无限接近7,故①错误;
![]() BaSO4的Ksp=c(Ba2+)c(SO42-),对于饱和BaSO4溶液中,有c(Ba2+)=c(SO42﹣)=
BaSO4的Ksp=c(Ba2+)c(SO42-),对于饱和BaSO4溶液中,有c(Ba2+)=c(SO42﹣)=![]() ,但是若溶液不是饱和溶液,c(Ba2+)=c(SO42﹣)<
,但是若溶液不是饱和溶液,c(Ba2+)=c(SO42﹣)<![]() ,该关系式不成立,故②错误;
,该关系式不成立,故②错误;
![]() 根据溶液中电荷守恒和物料守恒得
根据溶液中电荷守恒和物料守恒得 ![]() ,2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)],两式结合消去c(Na+)即得c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S),故③正确;
,2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)],两式结合消去c(Na+)即得c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S),故③正确;
![]() 氨水与盐酸刚好完全中和时的产物是氯化铵,铵根离子水解,结合水电离产生的氢氧根离子使氢离子浓度大于氢氧根离子浓度,所以溶液中的氢离子即水电离产生的氢离子,而水电离产生的氢离子与氢氧根离子浓度相等,所以
氨水与盐酸刚好完全中和时的产物是氯化铵,铵根离子水解,结合水电离产生的氢氧根离子使氢离子浓度大于氢氧根离子浓度,所以溶液中的氢离子即水电离产生的氢离子,而水电离产生的氢离子与氢氧根离子浓度相等,所以![]() ,故④正确;
,故④正确;
综上所述,③④正确,C项正确;
答案选C。

【题目】![]() 时,浓度均为
时,浓度均为![]() 的HA溶液和BOH溶液的pH分别是1和11。下列说法中正确的是
的HA溶液和BOH溶液的pH分别是1和11。下列说法中正确的是 ![]()
![]()
A.BOH的电离方程式为![]()
B.将一定体积的上述两种溶液混合后得到中性溶液,则![]()
C.在![]() 溶液中:
溶液中:![]()
D.若将![]() 溶液稀释至
溶液稀释至![]() ,则溶液的
,则溶液的![]()
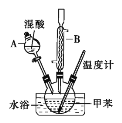
【题目】邻硝基甲苯和对硝基甲苯能被用作爆炸品检测的示踪剂。某探究小组利用下图反应和装置制备一硝基甲苯。
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:
①按体积比1∶3配制浓硫酸与浓硝酸的混合物80mL;②在250mL的三颈烧瓶中加入30mL(26g)甲苯,按图所示装好药品和其他仪器;③向三颈烧瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);④控制温度约为50℃,反应大约10min,三颈烧瓶底有大量淡黄色油状液体出现;⑤分离出一硝基甲苯的总质量为27.20g。
请回答下列问题:
(1)使用仪器A前必须进行的操作是_______。
(2)该实验采用水浴加热,水浴加热的优点有:受热均匀、_______。
(3)配制混酸的方法是分别量取20mL浓硫酸和60mL浓硝酸,将浓_______倒入烧杯中,浓_______沿着烧杯内壁缓缓注入,并不断搅拌。
(4)控制温度约为50℃时,反应生成的产物一硝基甲苯是邻硝基甲苯和对硝基甲苯混合物,写出该反应生成对硝基甲苯的化学方程式_______。
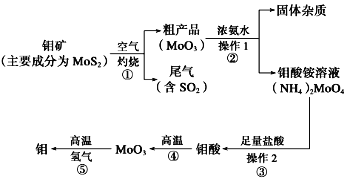
(5)分离反应后产物的方案如下:

①操作1的名称为_______。
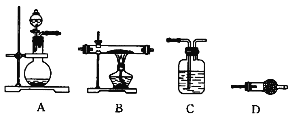
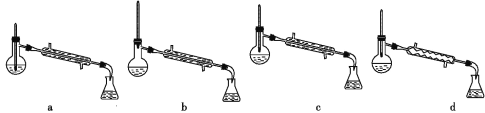
②操作2中,下列仪器选择及安装正确的是_______(填字母)。
(6)该实验中一硝基甲苯的产率为_______(保留两位有效数字)。