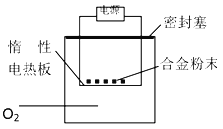
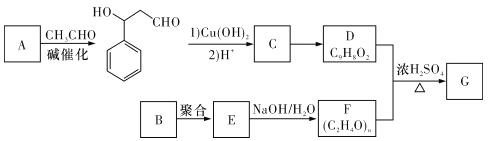
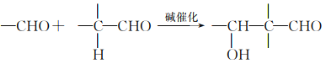题目内容
【题目】常温下向100 mL0.1mol/L的NaOH溶液中通入一定量的CO2。为探究反应后混合溶液的成分,向其中逐滴加入0.1 mol/L的HCl溶液。溶液产生气体前,消耗V( HCl)=V1;溶液刚好不再产生气体时,消耗V( HCl) =V2。当V1 <V2 <2Vl时,混合溶液中溶质的成分为
A. NaHCO3、Na2CO3 B. NaOH、NaHCO3 C. NaOH、Na2CO3 D. NaOH、Na2CO3、NaHCO3
【答案】C
【解析】滴加盐酸V1 mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,盐酸的体积为V2mL,HCO3-+H+=H2O+CO2↑;
A、混合溶液中成分为NaHCO3、Na2CO3 时,逐滴加入盐酸,依次发生反应:![]() 、
、![]() ,假设NaHCO3有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为bmol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,对应的溶液体积为2V1 <V2 ,故不选A项;B、 NaOH、NaHCO3溶液不能大量共存,故不选B项;C、混合溶液中成分为NaOH、Na2CO3时,逐滴加入盐酸,依次发生反应:
,假设NaHCO3有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为bmol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,对应的溶液体积为2V1 <V2 ,故不选A项;B、 NaOH、NaHCO3溶液不能大量共存,故不选B项;C、混合溶液中成分为NaOH、Na2CO3时,逐滴加入盐酸,依次发生反应:![]() 、
、![]() ,假设NaOH有amol,Na2CO3 有bmol,则刚产生气体时,消耗盐酸的物质的量为(a+b)mol,溶液中不再产生气体时,消耗的盐酸的物质的量为
,假设NaOH有amol,Na2CO3 有bmol,则刚产生气体时,消耗盐酸的物质的量为(a+b)mol,溶液中不再产生气体时,消耗的盐酸的物质的量为![]() ,因此
,因此![]() ,则对应成盐酸所用体积为V1 <V2 <2Vl,故C正确;D、 NaOH、NaHCO3溶液不能大量共存,故不选D项,故选C。
,则对应成盐酸所用体积为V1 <V2 <2Vl,故C正确;D、 NaOH、NaHCO3溶液不能大量共存,故不选D项,故选C。

练习册系列答案
相关题目