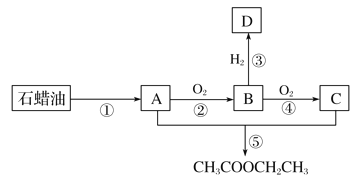
题目内容
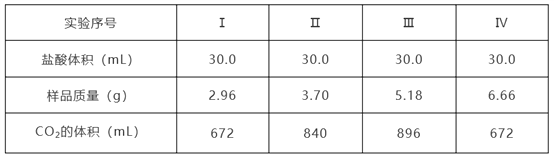
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
(1)样品中物质的量之比n(Na2CO3):n(NaHCO3)=_________。
(2)盐酸的物质的量浓度c(HCl)=______________。
【答案】 2:1或2 2.50mol/L
【解析】(1)对比Ⅰ、Ⅱ、Ⅲ可知,随着样品质量增加,生成二氧化碳的体积逐渐增大,说明Ⅰ、Ⅱ中盐酸过量,Na2CO3和NaHCO3完全反应,设出Ⅰ中碳酸钠、碳酸氢钠的物质的量,然后根据总质量、生成二氧化碳的量列式计算;
(2)根据实验Ⅲ、Ⅳ可知,Ⅳ中盐酸不足,碳酸钠优先反应生成碳酸氢钠,然后碳酸氢钠与盐酸反应生成二氧化碳,根据(1)的计算结果计算出碳酸钠的物质的量,再根据反应计算出HCl的物质的量,最后计算出该盐酸的浓度。
(1)结合Ⅰ、Ⅱ、Ⅲ可知,随着样品质量增加,生成二氧化碳的体积逐渐增大,说明Ⅰ、Ⅱ中盐酸过量,Na2CO3和NaHCO3完全反应,设出Ⅰ中Na2CO3、NaHCO3的物质的量分别为xmol、ymol,则①106x+84y=2.96、②x+y=0.672÷22.4=0.03,联立①②解得:x=0.02、y=0.01,所以样品中物质的量之比n(Na2CO3):n(NaHCO3)=0.02mol:0.01mol=2:1;
(2)根据实验Ⅲ、Ⅳ可知,Ⅳ中盐酸不足,Na2CO3优先反应生成NaHCO3,设6.66g样品中含有碳酸钠、碳酸氢钠的物质的量分别为2zmol、zmol,则106×2z+84z=6.66,解得:z=0.0225,即6.66g样品中含有0.045mol碳酸钠、0.0225mol碳酸氢钠。将样品加入盐酸中,先发生反应HCl+Na2CO3=NaHCO3+NaCl,0.045mol碳酸钠完全反应消耗HCl的物质的量为0.045mol,碳酸钠完全反应后发生再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,生成标准状况下0.672L二氧化碳消耗HCl的物质的量为:n(HCl)=n(CO2)=0.672L÷22.4L/mol=0.03mol,所以30mL盐酸中含有HCl的物质的量为:0.045mol+0.03mol=0.075mol,该盐酸的物质的量浓度为:c(HCl)=0.075mol÷0.03L=2.50mol/L。

【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路、陶瓷等生产领域。工业上由氧化铝与焦炭在氮气流中高温制得:Al2O3+3C+N2![]() 2AlN+3CO。请回答:
2AlN+3CO。请回答:
(1)上述反应中氧化剂与还原剂的物质的量之比___________________。
(2)制得的氮化铝产品中常含有Al4C3、Al2O3和C等杂质,已知:
稀硫酸(过量) | 浓NaOH溶液(过量) | |
AlN | 2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4 | AlN+NaOH+H2O=NaAlO2+NH3 ↑ |
Al4C3 | Al4C3+6H2SO4=2Al2(SO4)3+3CH4 ↑ | Al4C3+4NaOH+4H2O=4NaAlO2+3CH4 ↑ |
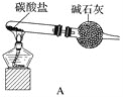
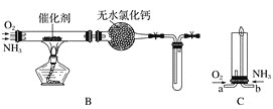
为测定产品中AlN和Al4C3的含量,设计了如下两套实验装置(在通风橱进行,可适当微热,忽略空气中水蒸气、CO2的影响及NH3在强碱性溶液中的溶解)。

装置I、II在反应前后的质量差分别为m1 g和m2 g,则m g产品中AlN的质量分数为______(用含m、m1、m2的代数式表示)。
(3)取装置I中反应后的滤液,先加入少量(NH4)2SO4溶液,然后依次进行蒸发浓缩、冷却结晶、过滤、用少量酒精洗涤、滤纸吸干,得到铵明矾晶体[NH4Al(SO4)2·12H2O]。
①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要_______(填仪器名称);蒸发浓缩的操作;小火加热,不断搅拌,_________。
②用少量酒精洗涤的目的__________________________。
(4)已知:25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9。
① NH4Al(SO4)2溶液中离子浓度由大到小的顺序_________________。
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数为_____________。