题目内容
【题目】资料显示:“氨气可在纯氧中安静燃烧……”。某校化学兴趣小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验对比。
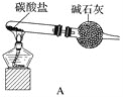
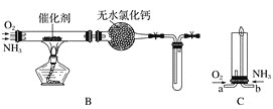
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是____________________;碱石灰的作用是__________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式__________________;试管内气体变为红棕色,该反应的化学方程式是_______________________。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请说明可能的原因________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气生成氮气和水:
①两气体通入的先后顺序是_____________,其理由是______________________。
②氨气燃烧的化学方程式是_______________
【答案】(NH4)2CO3或NH4HCO3 吸收水和二氧化碳 4NH3+5O2![]() 4NO+6H2O 2NO+O2===2NO2 红棕色的二氧化氮转化为无色N2O4颜色变浅 先通氧气,后通氨气 若先通氨气,氨气在空气中不能燃烧,逸出造成环境污染 4NH3+3O2
4NO+6H2O 2NO+O2===2NO2 红棕色的二氧化氮转化为无色N2O4颜色变浅 先通氧气,后通氨气 若先通氨气,氨气在空气中不能燃烧,逸出造成环境污染 4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
【解析】
(1)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,碱石灰可以吸收酸性气体,并用于干燥氨气;
(2) NH3与过量O2在催化剂、加热条件下发生反应: 4NH3+5O2![]() 4NO+6H2O ,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体;
4NO+6H2O ,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体;
(3)①若先通入NH3,NH3在空气中不能点燃,可在纯氧中安静燃烧,依次进行判断;
②NH3中N元素的化合价为-3价,为最低价态,具有还原性,在点燃条件下生成N2和H2O.
(1)铵盐不稳定,受热分解产生氨气,根据装置图可知是用碳酸盐加热制取氨气,则应该是碳酸铵或碳酸氢铵,所以用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是(NH4)2CO3或NH4HCO3;(NH4)2CO3或NH4HCO3加热发生分解反应产生氨气、二氧化碳和水蒸气,要证明氨气可以燃烧,要将混合气体中的二氧化碳和水蒸气除去,但不能与氨气发生反应,利用碱石灰就可以吸收CO2和H2O,得到纯净的NH3;
本题答案为:(NH4)2CO3或NH4HCO3 , 吸收水和二氧化碳。
(2)①将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨在催化剂存在时被氧化产生NO和水,可得氨气催化氧化的化学方程式是:4NH3+5O2![]() 4NO+6H2O;试管内NO和O2反应,生成NO2变为红棕色,该反应的化学方程式:2NO+O2=2NO2;
4NO+6H2O;试管内NO和O2反应,生成NO2变为红棕色,该反应的化学方程式:2NO+O2=2NO2;
本题答案为:4NH3+5O2![]() 4NO+6H2O,2NO+O2=2NO2。
4NO+6H2O,2NO+O2=2NO2。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,是因为:红棕色的二氧化氮转化为无色N2O4颜色变浅;
本题答案为:红棕色的二氧化氮转化为无色N2O4颜色变浅。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气,①由于氨气可以在纯净的氧气中安静的燃烧,所以应该先通入氧气,把装置中的空气赶出;然后再通入氨气;先通入氧气,后通入氨气的理由是若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
本题答案为:先通氧气,后通氨气,若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染。
②氨气在氧气中燃烧,反应产生氮气和水,反应的化学方程式是4NH3+3O2![]() 2N2+6H2O;
2N2+6H2O;
本题答案为:4NH3+3O2![]() 2N2+6H2O。
2N2+6H2O。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
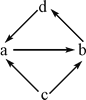
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】下列各组物质中,物质之间通过一步反应就能实现图示变化的是
物质编号 | 物质转化关系 | a | b | c | d |
① |
| NO | NO2 | N2 | HNO3 |
② | Na2O | Na2O2 | Na | NaOH | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. ①②③ B. ③④
C. ①③④ D. ②④
【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
t /min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(Lmin)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大