题目内容
【题目】脱硫渣是铁水在进入转炉前进行脱硫处理时产生的废弃物,现以某工厂废弃的脱硫渣(主要成分为Fe、CaO及少量MgO、Al2O3、SiO2)为原料,制备高纯度硫酸亚铁晶体的流程如下:
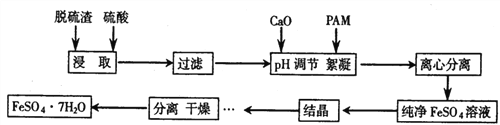
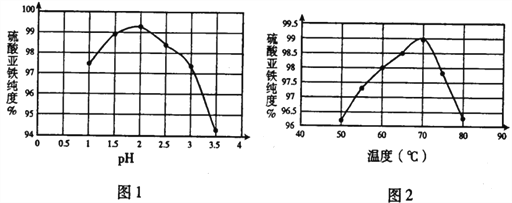
(1)在结晶过程中,pH、温度对硫酸亚铁纯度的影响如图1、图2,则蒸发结晶时适宜的条件为_____。
(2)离心分离后在30℃下干燥6h后得高纯度硫酸亚铁晶体,30℃下干燥其原因可能是______。
(3)实验室进行过滤操作时所需用到的玻璃仪器有_______。
(4)硫酸亚铁晶体可用来净化硫酸亚铁晶体可用来净化含K2Cr2O7废水,取一定质量的FeSO4·7H2O 和足量的KOH溶液加入到含K2Cr2O7废水中可得到一定量的磁性材料Cr0.5Fe1.5FeO4,处理含5.00×10-3mol K2Cr2O7的废水,需要多少克的FeSO4·7H2O(写出计算过程)。_______________
【答案】 pH=2、70℃下蒸发结晶 高于30℃晶体易失去结晶水 烧杯、玻璃棒、漏斗 13.9g
【解析】(1)根据图示可知,当pH=2时,硫酸亚铁的纯度最大;当温度为70℃时,硫酸亚铁的纯度最大;正确答案:pH=2、 70℃下蒸发结晶 。
(2)硫酸亚铁晶体中含有结晶水,温度高于30℃,晶体易失去结晶水,正确答案:高于30℃晶体易失去结晶水。
(3)实验室进行过滤操作时所需用到的玻璃仪器有烧杯、玻璃棒、漏斗,正确答案:烧杯、玻璃棒、漏斗。
(4)设处理处理含5.00×10-3mol K2Cr2O7的废水,需要FeSO4·7H2O的物质的量为xmol,根据信息可知:
10 FeSO4+18KOH+ K2Cr2O7=10K2SO4+4 Cr0.5Fe1.5FeO4+9H2O
10 1
x 5.00×10-3
解之得x= 5.00×10-2mol,所以需要绿矾物质的量为5.00×10-2mol,所以需要FeSO4·7H2O的质量为5.00×10-2×278=13.9g,正确答案:13.9 g。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
t /min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(Lmin)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大