题目内容
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路、陶瓷等生产领域。工业上由氧化铝与焦炭在氮气流中高温制得:Al2O3+3C+N2![]() 2AlN+3CO。请回答:
2AlN+3CO。请回答:
(1)上述反应中氧化剂与还原剂的物质的量之比___________________。
(2)制得的氮化铝产品中常含有Al4C3、Al2O3和C等杂质,已知:
稀硫酸(过量) | 浓NaOH溶液(过量) | |
AlN | 2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4 | AlN+NaOH+H2O=NaAlO2+NH3 ↑ |
Al4C3 | Al4C3+6H2SO4=2Al2(SO4)3+3CH4 ↑ | Al4C3+4NaOH+4H2O=4NaAlO2+3CH4 ↑ |
为测定产品中AlN和Al4C3的含量,设计了如下两套实验装置(在通风橱进行,可适当微热,忽略空气中水蒸气、CO2的影响及NH3在强碱性溶液中的溶解)。
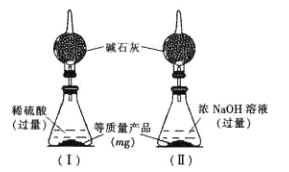
装置I、II在反应前后的质量差分别为m1 g和m2 g,则m g产品中AlN的质量分数为______(用含m、m1、m2的代数式表示)。
(3)取装置I中反应后的滤液,先加入少量(NH4)2SO4溶液,然后依次进行蒸发浓缩、冷却结晶、过滤、用少量酒精洗涤、滤纸吸干,得到铵明矾晶体[NH4Al(SO4)2·12H2O]。
①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要_______(填仪器名称);蒸发浓缩的操作;小火加热,不断搅拌,_________。
②用少量酒精洗涤的目的__________________________。
(4)已知:25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9。
① NH4Al(SO4)2溶液中离子浓度由大到小的顺序_________________。
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数为_____________。
【答案】 1:3 [41(m2-m1)/17m]× 100% 蒸发皿 当液面上出现晶膜时停止加热 洗去晶体表面附着的水分 c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-) 5.6×10-10
【解析】(1)根据反应Al2O3+N2+3C![]() 2AlN+3CO,反应中氮元素化合价从0价变化为-3价,做氧化剂,被还原为AlN,碳元素化合价从0价变化为+2价,做还原剂,被氧化为一氧化碳,所以氧化剂与还原剂的物质的量之比为1:3;故答案为:1:3;
2AlN+3CO,反应中氮元素化合价从0价变化为-3价,做氧化剂,被还原为AlN,碳元素化合价从0价变化为+2价,做还原剂,被氧化为一氧化碳,所以氧化剂与还原剂的物质的量之比为1:3;故答案为:1:3;
(2)根据发生的反应:装置I中发生2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4、Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑,则生成甲烷的质量为m1g,装置II中发生AlN+NaOH+H2O=NaAlO2+NH3↑、Al4C3+4NaOH+4H2O=4NaAlO2+3CH4↑,生成的甲烷和氨气的质量之和为m2 g,则生成氨气的质量为(m2- m1)g,因此AlN的质量为![]() ×41g/mol=
×41g/mol=![]() g,因此mg产品中AlN的质量分数为
g,因此mg产品中AlN的质量分数为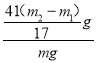 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%;
×100%;
(3) ①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要蒸发皿;蒸发浓缩的操作;小火加热,不断搅拌,当液面上出现晶膜时,停止加热,故答案为:蒸发皿;当液面上出现晶膜时,停止加热;
②用少量酒精洗涤,可以洗去晶体表面附着的水分,同时可以减少铵明矾晶体的损失,故答案为:洗去晶体表面附着的水分;
(4)①根据Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9可知,碱性NH3·H2O >Al(OH)3,则NH4Al(SO4)2溶液中Al3+水解程度大于NH4+,溶液显酸性,离子浓度由大到小的顺序为c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-),故答案为:c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-);
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数K=![]() =
=![]() =5.6×10-10,故答案为:5.6×10-10。
=5.6×10-10,故答案为:5.6×10-10。

 应用题作业本系列答案
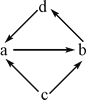
应用题作业本系列答案【题目】下列各组物质中,物质之间通过一步反应就能实现图示变化的是
物质编号 | 物质转化关系 | a | b | c | d |
① |
| NO | NO2 | N2 | HNO3 |
② | Na2O | Na2O2 | Na | NaOH | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. ①②③ B. ③④
C. ①③④ D. ②④