题目内容
甲、乙两种金属性质比较:①甲的单质熔、沸点比乙的低;②常温下,甲能与水反应放出氢气而乙不能;③最高价氧化物对应的水化物碱性比较,乙比甲的强;④甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡。上述项目中能够说明甲比乙的金属性强的是( )
| A.①② | B.②④ | C.②③ | D.①③ |
B
解析试题分析:①金属性的强弱与单质的熔、沸点的高低无关,错误;②常温下,甲能与水反应放出氢气而乙不能,所以甲的金属性强于乙,正确;③最高价氧化物对应的水化物碱性比较,乙比甲的强,则甲比乙的金属性弱,错误;④甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡,说明乙为正极,则甲比乙的金属性强,正确,故B项正确。
考点:本题考查金属性强弱的判断。

 口算题天天练系列答案
口算题天天练系列答案短周期元素A和B可形成AB3型化合物。若B原子序数为m,则A的原子序数为下面算式中的①m+6 ②m+4 ③m-4 ④m-2 ⑤m+8 ⑥m+14 ⑦m-12
| A.②③⑥ | B.①②③④ | C.①②⑥⑦ | D.①②③④⑤⑥⑦ |
已知X、Y是主族元素,I为电离能,单位kJ/mol。根据下表所列数据判断错误的是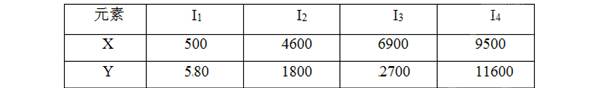
| A.元素X的常见化合物价是+1价 |
| B.若元素Y处于第3周期,它可与冷水剧烈反应 |
| C.元素X与氯形成化合物时,化学式可能是XCl |
| D.元素Y是ⅢA族的元素 |
下列有关原子结构和元素周期律表述正确的是
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
| A.①② | B.①③ | C.②④ | D.③④ |
月球上含有丰富的He。关于 He的说法不正确的是
He的说法不正确的是
| A.是一种核素 | B.原子核内有1个中子 |
C.与 He互为同位素 He互为同位素 | D.比 He少一个电子 He少一个电子 |
a、b、c、d、e是同周期的五种元素,a和b最高价氧化物对应的水化物呈碱性,且碱性b>a,c 和d的气态氢化物的稳定性c>d;五种元素的原子得失电子后形成的简单离子中 e半径最小,下列叙述中正确的是( )
| A.原子序数关系是b <a< d< c< e | B.离子半径关系是d >c> e> b> a |
| C.原子半径关系是b> a> e> d >c | D.最外层电子数关系为c >d > a >b>e |
下列各分子中,所有原子都满足最外层为8电子结构的是
| A.H2O | B.BF3 | C.CCl4 | D.PCl5 |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( ) 
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
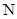
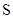
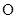
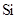
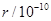 m
m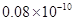 m B.
m B.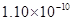 m C.
m C. m D.
m D.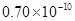 m
m