题目内容
a、b、c、d、e是同周期的五种元素,a和b最高价氧化物对应的水化物呈碱性,且碱性b>a,c 和d的气态氢化物的稳定性c>d;五种元素的原子得失电子后形成的简单离子中 e半径最小,下列叙述中正确的是( )
| A.原子序数关系是b <a< d< c< e | B.离子半径关系是d >c> e> b> a |
| C.原子半径关系是b> a> e> d >c | D.最外层电子数关系为c >d > a >b>e |
C
解析试题分析:a、b、c、d、e是同周期的五种元素,a和b最高价氧化物对应的水化物呈碱性,且碱性b>a,则原子序数a>b;c、d大于a;元素的非金属性越强,其相应的氢化物的稳定性就越强,由于c 和d的气态氢化物的稳定性c>d;所以原子序数c>d;在这五种元素的原子得失电子后形成的简单离子中 e半径最小,则e是金属元素,形成的的金属阳离子。所以原子序数e>a.e<d。因此这五种元素的原子序数关系是:c>d>e>a>b.因此选项A错误。e、a、b是金属元素,形成的金属阳离子电子层结构相同,比原子少一个电子层,c、d形成的是阴离子,比原子多一个电子层。对于电子层结构相同的微粒来说,核电荷数越大。离子半径就越小,对于电子层结构不同的微粒来说,离子核外电子层数越多,离子半径就越大,所以离子半径关系是d >c> b> a> e,选项B错误;同一周期的元素,原子序数越大,离子半径就越小,所以原子半径关系是b> a> e> d >c。因此选项C正确;元素序数越大,原子的最外层电子数就越多。因此最外层电子数关系为c >d >e > a >b,故选项D错误。
考点:考查元素的原子结构、元素在周期表中的位置及性质的关系的知识。

下列各组中两种微粒所含电子数不相等的是
| A.H3O+和OH- | B.CO和N2 | C.HNO2和NO2- | D.CH3+和NH4+ |
下列说法正确的是( )
| A.原子最外层只有1个电子的元素一定是金属元素 |
| B.原子最外层只有2个电子的元素一定是金属元素 |
| C.最外层电子数比次外层电子数多的元素一定位于第二周期 |
| D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
甲、乙两种金属性质比较:①甲的单质熔、沸点比乙的低;②常温下,甲能与水反应放出氢气而乙不能;③最高价氧化物对应的水化物碱性比较,乙比甲的强;④甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡。上述项目中能够说明甲比乙的金属性强的是( )
| A.①② | B.②④ | C.②③ | D.①③ |
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是
| A.原子半径:丙<丁<戊 | B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 | D.最外层电子数:甲>乙 |
元素X的原子核外M电子层上有3个电子,元素Y的简单阴离子为Y2-,则这两种元素可形成的化合物为
| A.XY2 | B.X3Y2 | C.X2Y3 | D.X2Y |
下列说法正确的是
| A.CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 |
| B.第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 |
| C.第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 |
| D.第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法不正确的是
| A.气态氢化物的稳定性:HX>H2Y>ZH3 | B.非金属活泼性:Z<Y<X |
| C.单质的氧化性:X2>Y>Z | D.原子最外电子层上的电子数相等 |
放射性同位素铀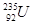 的原子核内的中子数是
的原子核内的中子数是
| A.51 | B.92 | C.143 | D.235 |