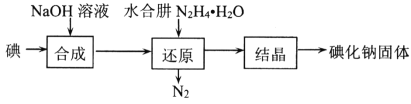
题目内容
【题目】下列有关离子方程式正确的是( )
A.将氟气通入水中: ![]() =
=![]()
B.硝酸银溶液中滴加过量氨水: ![]() =
=![]()
C.将磁性氧化铁溶于盐酸: ![]() =
=![]()
D.往![]() 溶液中滴入
溶液中滴入![]() 溶液至沉淀的物质的量最大
溶液至沉淀的物质的量最大![]() =
=![]()
【答案】C
【解析】
A.将氟气通入水中发生的反应为F2+ 2H2O=4HF+O2,A选项错误;
B.硝酸银溶液中滴加过量氨水得到的是银氨溶液,无沉淀生成,B选项错误;
C.将磁性氧化铁溶于盐酸发生的离子反应为Fe3O4+8H+=2Fe3++Fe2++4H2O,C选项正确;
D.在硫酸铝钾溶液中滴加氢氧化钡至沉淀物质的量最多,铝离子完全转化成氢氧化铝沉淀,硫酸根离子部分参与反应,反应的离子方程式为:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓,D选项错误;
故答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】空气中的硫酸盐会加剧雾霾的形成,我国科学家用下列实验研究其成因:反应室底部盛有不同吸收液。将SO2和NO2按一定比例混合,以N2或空气为载气通入反应室,相同时间后,检测吸收液中SO42-的含量数据如下表所示,下列说法正确的是
反应室 | 载气 | 吸收液 | SO42-含量 | 数据分析 |
① | N2 | 蒸馏水 | a | b |
② | 3%氨水 | b | ||
③ | 空气 | 蒸馏水 | c | |
④ | 3%氨水 | d |
A.实验表明:酸性环境下,更有利于硫酸盐的形成
B.本研究表明:硫酸盐的形成主要与N2有关
C.反应室①中可能发生反应:SO2+2NO2+2H2O=H2SO4+2HNO2
D.燃煤产生的气体盲目排放会引起酸雨但不会加剧雾霾形成