题目内容
8.甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.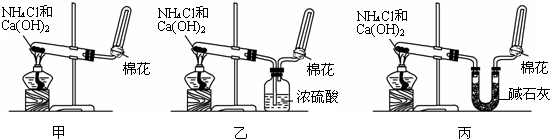
请你参与研究,并回答有关问题:
(1)三位同学所用化学药品制取氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气,如果他的实验操作都正确,收集不到氨气的主要原因是通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收.
(3)你检验氨气是否收集满的方法是(简述操作方法、现象和结论)用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满.
(4)三位同学都认为他们的实验装置也可用加热碳酸氢铵固体制取氨气,你判断他们能够达到实验目的是丙(填“甲”、“乙”或“丙”),其理由是分解得到二氧化碳、氨气和水蒸气,通过碱石灰,吸收二氧化碳和水蒸气得到纯净干燥的氨气.
分析 (1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,还生成氯化钙、水;
(2)氨气能与硫酸反应而被硫酸吸收;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性;
(4)碳酸氢铵加热分解生成氨气、二氧化碳和水,可以用碱石灰除杂.
解答 解:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,反应方程式为2NH3+H2SO4=(NH4)2SO4,
故答案为:通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,检验时可用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满,故选:C;
(4)碳酸氢铵受热分解生成氨气、水和二氧化碳.甲收集到的是混合气体,得不到纯净氨气,乙分解得到二氧化碳、氨气和水蒸气通过浓硫酸氨气被吸收得不到氨气,丙分解得到二氧化碳、氨气和水蒸气,通过碱石灰,吸收二氧化碳和水蒸气得到纯净干燥的氨气,故答案为:丙;分解得到二氧化碳、氨气和水蒸气,通过碱石灰,吸收二氧化碳和水蒸气得到纯净干燥的氨气.
点评 本题考查实验装置的综合应用,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意氨气的实验室制取方法,题目难度不大.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案| A. | a=10、b=9.2 | B. | a<10、b>9.2 | C. | a>10、b=9.2 | D. | a>10、b<9.2 |
| A. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 常温下,pH=1的H2SO4溶液中含有的H+的数目为0.1NA | |
| C. | 标准状况下,2.24L SO3中含有硫原子的数目为NA | |
| D. | 标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA |
| A. | 只能为2 | B. | 只能为3 | ||
| C. | 可能为2,也可能为3 | D. | 无法确定 |
| A. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 | |
| B. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝 | |
| C. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| D. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水有漂白性 |
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2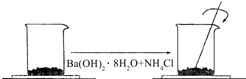 在一个小烧杯里,加入 40g Ba(OH)2•8H2O粉末,将小烧杯放在事先已滴有4~5滴水的玻璃片上.然后加入20g NH4Cl晶体,并用玻璃棒迅速搅拌.如图所示.回答下列问题:
在一个小烧杯里,加入 40g Ba(OH)2•8H2O粉末,将小烧杯放在事先已滴有4~5滴水的玻璃片上.然后加入20g NH4Cl晶体,并用玻璃棒迅速搅拌.如图所示.回答下列问题: