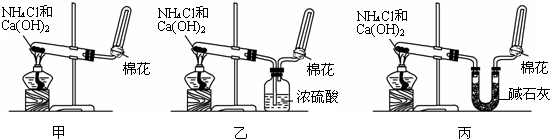
题目内容
19.已知溶质质量分数为98%的浓硫酸,其物质的量浓度为18.4mol/L,取10mL该硫酸与a mL水混合,配制成溶质质量分数为49%的硫酸,其物质的量浓度为bmol/L,则a,b分别为( )| A. | a=10、b=9.2 | B. | a<10、b>9.2 | C. | a>10、b=9.2 | D. | a>10、b<9.2 |
分析 根据稀释过程中溶质硫酸的质量不变列方程计算加入水的体积a,结合c=$\frac{1000ρω}{M}$mol/L判断49%的硫酸的浓度,注意硫酸的浓度越大,其密度越大.
解答 解:稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98%=(10mL×1.84g/mL+amL×1g/mL)×49%,解得a=18.4>10;
设49%的硫酸的密度为ρg/mL,硫酸的浓度越大密度越大,则ρ<1.84,49%的硫酸的物质的量浓度b=$\frac{1000ρ×49%}{98}$mol/L=5ρ mol/L<9.2mol/L,
故选D.
点评 本题考查溶液浓度的有关计算,题目难度中等,注意掌握物质的量浓度与质量分数之间的关系,明确硫酸的浓度越大密度越大为解答关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.正确的化学实验操作对实验结果、人身安全非常重要.下图中的实验操作正确的是( )
| A. |  闻气体气味 | B. |  取用块状固体 | ||
| C. |  滴加液体 | D. |  稀释浓硫酸 |
11.几种短周期元素的原子半径及主要化合价如表所示:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5+3-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物的水化物能溶于稀氨水 | |
| D. | Z的最高价氧化物的水化物是强酸 |
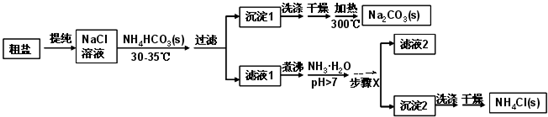
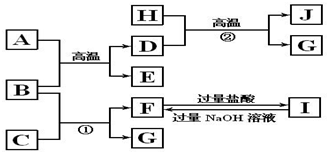
 ,若D最外层只有两个电子,则D的原子结构示意图
,若D最外层只有两个电子,则D的原子结构示意图 ;
;