题目内容
13.有关下列装置或操作的说法正确的是( )| A. | 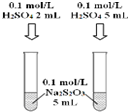 可以探究H2SO4浓度对反应速率的影响 | |
| B. | 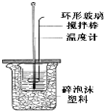 用于测定中和热时应该用稍过量的NaOH溶液和盐酸反应 | |
| C. | 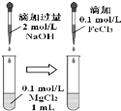 可以探究Mg(OH)2能否转化成Fe(OH)3 | |
| D. | 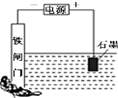 中金属防护方法叫做牺牲阳极的阴极保护法 |
分析 A.硫酸浓度相同,如滴加,则不能验证浓度对反应速率的影响;
B.测定中和热时注意减小实验误差;
C.氢氧化钠过量,不能完成验证实验;
D.为外加电源的阴极保护法.
解答 解:A.硫酸浓度相同,如滴加,则不能验证浓度对反应速率的影响,引用浓度不同的硫酸,故A错误;
B.测定中和热时注意减小实验误差,可完成实验,故B正确;
C.氢氧化钠过量,加入氯化铁肯定生成氢氧化铁沉淀,不能完成验证实验,故C错误;
D.为外加电源的阴极保护法,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及影响化学反应速率的因素、中和热的测定、难溶电解质的转化以及金属的腐蚀与防护,把握物质的性质、反应原理、实验基本技能为解答的关键,侧重实验评价分析的考查,注意实验装置的作用,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
相关题目
15.石墨烯的结构示意图如图所示,下列说法正确的是( )
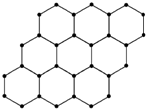

| A. | 石墨烯与石墨互称为同位素 | |
| B. | 12 g石墨烯中约含有6.02×1023个电子 | |
| C. | 石墨烯中可能含有离子键 | |
| D. | 石墨烯中的碳原子间以共价键相结合 |
16.仅用下表提供的仪器(夹持仪器和试剂任选)不能达到相应实验目的一组是( )
| 选项 | 实验目的 | 仪器 |
| A | 用溴水和CCl4除去NaBr溶液中少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| B | 配制100mL l.0mol•L-1的NaOH溶液 | 药匙、天平、量筒、烧杯、玻璃棒、胶头滴管、100mL的容量瓶 |
| C | 从食盐水中获得NaCl晶体 | 酒精灯、玻璃棒、坩埚、泥三角 |
| D | 用盐酸除去BaSO4中混有的少量BaCO3 | 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| A. | A | B. | B | C. | C | D. | D |
1.电子工业中,可用FeCl3-HCl溶液作为印刷电路铜板蚀刻液.某探究小组设计如下线路处理废液和资源回收:
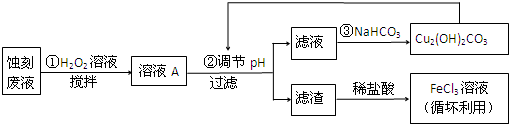
请回答:
(1)FeCl3-HCl溶液蚀刻铜板后的废液中含有的金属阳离子是Fe3+、Fe2+和Cu2+.
(2)FeCl3蚀刻液中加入盐酸的目的:可以抑制氯化铁水解,又可提高蚀刻速率.
(3)步骤①中加入H2O2溶液的目的是因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
(4)已知:
生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是3.2≤pH<4.7.
(5)写出步骤②中生成CO2的一个离子方程式4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3不易溶于水).
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式2Cu2++4HCO3-=Cu2(OH)2CO3↓+H2O+3 CO2↑.

请回答:
(1)FeCl3-HCl溶液蚀刻铜板后的废液中含有的金属阳离子是Fe3+、Fe2+和Cu2+.
(2)FeCl3蚀刻液中加入盐酸的目的:可以抑制氯化铁水解,又可提高蚀刻速率.
(3)步骤①中加入H2O2溶液的目的是因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
(4)已知:
生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)写出步骤②中生成CO2的一个离子方程式4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3不易溶于水).
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式2Cu2++4HCO3-=Cu2(OH)2CO3↓+H2O+3 CO2↑.
8.下列说法正确的是( )
| A. |  三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 | |
| B. | 戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯 | |
| C. | 分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种 | |
| D. | 将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2 |
18.下列说法正确的是( )
| A. | 按系统命名法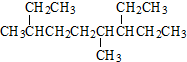 的名称为:4,7-二甲基-3-乙基辛烷 的名称为:4,7-二甲基-3-乙基辛烷 | |
| B. | 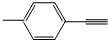 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 肌醇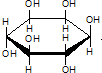 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 | |
| D. | 1.0 mol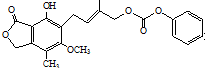 最多能与含5 mol NaOH的水溶液完全反应 最多能与含5 mol NaOH的水溶液完全反应 |
5.下列溶液加热蒸干灼烧后,能得到该溶质固体的是( )
| A. | Al2(SO4)3 | B. | NaHCO3 | C. | Fe(NO3)3 | D. | NH4Cl |
3.50mL BaCl2溶液和20mL0.5mol/L的AgNO3溶液混合后,恰好完全反应,则BaCl2溶液中Cl-的物质的量浓度是( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.8mol/L | D. | 1mol/L |