题目内容
【题目】下列体系中,离子能大量共存的是( )
A.含1.2 mol·L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br-
B.使酚酞变红的溶液:K+、Na+、![]() 、Cl-
、Cl-
C.滴加KSCN显红色的溶液:![]() 、K+、Cl-、I-
、K+、Cl-、I-
D.0.1 mol·L-1 NaHCO3溶液:Na+、Ba2+、![]() 、
、![]()
【答案】B
【解析】
A.NO3-、H+、Fe2+之间能够发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.使酚酞变红的溶液呈碱性,K+、Na+、NO3-、C1-之间不反应,且都不与氢氧根离子反应,在碱性溶液中能够大量共存,故B正确;
C.滴加KSCN显红色的溶液中存在铁离子,铁离子具有氧化性,能够氧化I-,在溶液中不能大量共存,故C错误;
D.NaHCO3、AlO2-能够反应生成碳酸钠和氢氧化铝沉淀,在溶液中不能大量共存,故D错误;
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
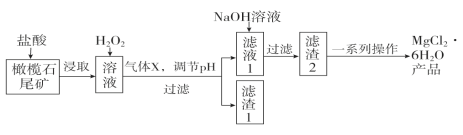
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____________、__________(任写两种)。
(2)气体X的电子式为________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为________。
(3)加入H2O2的目的是______________________;若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为:________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过____________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加水50 mL使其完全溶解,加入100 mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.5000 mol/L的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4- ==MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00 mL。
①则产品中MgCl2·6H2O的质量分数为________(结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是________(填字母)。
a.滴定终点时仰视读数 b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出 d.滴定管滴定前有气泡,滴定后气泡消失


