题目内容
【题目】可逆反应aA(g)+bB(s) cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

A.升高温度,平衡向正反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.根据图象无法确定改变温度后平衡移动方向
【答案】C
【解析】可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T2>T1 , 温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1 , 压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即a<c+d;A、正反应为放热反应,升温平衡逆向移动,故A错误;B、催化剂只改变化学反应速率,对平衡移动没有影响,C的质量分数不变,故B错误;C、压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即a<c+d,故C正确;D、T2>T1 , 温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应,升温平衡逆向移动,故D错误;所以选C.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).

【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略). 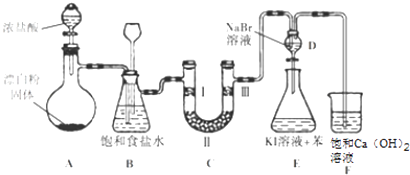
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是 , 请写出该反应相应的离子方程式: .
(2)装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象: .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是(填字母编号).
编号 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 , 该现象(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是(用必要的文字和离子方程式回答).
(5)此装置需要改进之处是:原因是: .