��Ŀ����
����Ŀ��MnO2����Ҫ��ѧ���ʣ�ijѧϰС������˽���MnO2�����н϶��MnO��MnCO3��Fe2O3����Ʒת��Ϊ��MnO2ʵ�飬��������ͼ�� 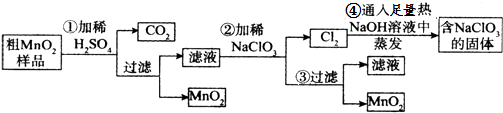
��Ҫ��ش���������
��1���ڢڲ������У�������ǿ��˳��ClO3��MnO2 �����������������д���������з�����Ӧ�����ӷ���ʽ������Ӧ��ת��2mol����ʱ�����ɵ�������������ʵ���Ϊmol��
��2���ڢܲ������У����յõ��Ĺ����NaClO3�⣬��һ���������������е� ��
a��NaCl b��NaClO c��NaClO4 d��NaOH
��3��Ϊ�õ�������MnO2 �� �뽫���˺��MnO2�ϲ������ϴ�ӣ��ж��Ƿ�ϴ�Ӹɾ���ѡ�õ��Լ�������дһ�鼴�ɣ���
���𰸡�
��1������Mn2+��2e��+2H2O=MnO2+4H+��1
��2��ad
��3��BaCl2
���������⣺��MnO2�����н϶��MnO��MnCO3��Fe2O3����Ʒ�м��������ϡ���ᣬ����MnO2���������ᣬ����Ʒ�е�MnO��MnCO3�ֱ�����ᷴӦ���ɿ����Ե�MnSO4 �� ���˵���ҺΪ��������Һ������NaClO3������ӦΪ��5Mn2++2ClO3��+4H2O=5MnO2+Cl2��+8H+ �� �ٹ��˵õ���Һ�Ͷ������̹��壬���������ȵ��������Ʒ�Ӧ���������Ʒ���ʽΪ��3Cl2+6NaOH=NaClO3+NaCl+3H2O.
��1.����֪5Mn2++2ClO3��+4H2O=5MnO2+Cl2��+8H+ �� ClO3������������MnO2����������������ԣ�ClO3����MnO2����NaClO3ת��2mol����ʱ������NaClO3Ϊ0.4mol����������������MnO2Ϊ1mol��NaClO3�ڳ����������ᷴӦ�����������䷴Ӧ�����ӷ���ʽΪ��ClO3��+5Cl��+6H+=3Cl2��+3H2O��
���Դ��ǣ�����ClO3��+5Cl��+6H+=3Cl2��+3H2O��1��
��2.���ڢܲ�������NaOH�����������ķ�ӦΪ��3Cl2+6NaOH=NaClO3+NaCl+3H2O�������յõ��Ĺ����NaClO3�⣬����NaOH��NaCl�����Դ��ǣ�ad��
��3.��������û��ϴ�Ӹɾ�������Һ�к�����������ӣ��������������ѡ���Ȼ�����Һ�����Դ��ǣ�BaCl2 ��

����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��г��豸���ԣ��� 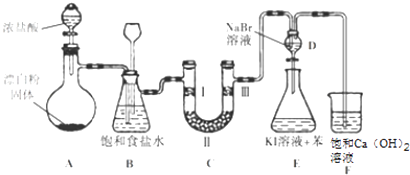
��1��װ��A�������ķ���װ�ã�����ʢ��Ũ��������������� �� ��д���÷�Ӧ��Ӧ�����ӷ���ʽ�� ��
��2��װ��B�б���ʳ��ˮ����������ͬʱװ��BҲ�ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������д����������ʱB�е����� ��
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η������ʵ����Ӧ��������ĸ��ţ���
��� | �� | �� | �� |
a | �������ɫ���� | ��ʯ�� | ʪ�����ɫ���� |
b | �������ɫ���� | ��ˮ����ͭ | ʪ�����ɫ���� |
c | ʪ�����ɫ���� | Ũ���� | �������ɫ���� |
d | ʪ�����ɫ���� | ��ˮ�Ȼ��� | �������ɫ���� |
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ������ԣ���Ӧһ��ʱ���������װ��D��������Һ����װ��E�У����۲쵽�������� �� ����������ܡ����ܡ���˵���嵥�ʵ�������ǿ�ڵ⣬ԭ�������ñ�Ҫ�����ֺ����ӷ���ʽ�ش𣩣�
��5����װ����Ҫ�Ľ�֮���ǣ�ԭ���ǣ� ��



