题目内容
【题目】自然界存在丰富的碳、氮、硅、磷、铁、铜等元素,它们可形成单质及许多化合物。回答下列问题:
(1)C、N、Si原子的第一电离能由大到小的顺序是____________________。
(2)亚磷酸(H3PO3)与过量NaOH反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸的结构式为________________________。
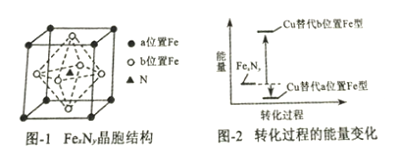
(3)某FexNy的晶胞结构如图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图-2所示,其中更稳定的Cu替代型产物的化学式为___________________。
(4)乙酰基二茂铁是常用汽油抗震剂,其结构如图3所示,该物质中碳原子的杂化方式有___________,亚铁离子具有强还原性,从电子排布的角度解释其原因_______________。

(5)金刚石晶胞结构如图-4,立方BN结构与金刚石相似、硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键数目比为____________;每个N原子周围最近且等距离的N原子数为_______________;如果阿伏加德罗常数近似取6×1023mol-1,立方BN的密度为ag·cm-3,摩尔质量为bg·mol-1,计算晶体中最近的两个N原子间距离是_________nm(用含a、b代数式表示)。
【答案】 N>C>Si 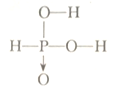 Fe3CuN sp3、sp2 Fe2+的3d轨道有6个电子,失去1个电子后3d轨道电子排布处于半充满稳定状态 3:1 12
Fe3CuN sp3、sp2 Fe2+的3d轨道有6个电子,失去1个电子后3d轨道电子排布处于半充满稳定状态 3:1 12 ![]()
【解析】(1)C、N是同一周期元素,但N原子2p轨道半充满较C原子更稳定,故N的第一电离能更大, C、Si是同一主族,从上到下失电子能力增强,故Si第一电离能小于C,故C、N、Si原子的第一电离能由大到小的顺序是:
N>C>Si;
(2)亚磷酸(H3PO3)与过量NaOH反应生成亚磷酸氢二钠(Na2HPO3),说明亚磷酸(H3PO3)是二元酸,其结构中,应有两个羟基、一个非羟基氧,P与这个非羟基氧形成的是配位键,则亚磷酸的结构式为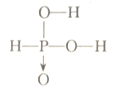 ;
;
(3)根据题意,Cu替代a位置Fe型具有的能量更高,更稳定,FexNy晶体的化学式为:Fe4N,a位置铁是晶胞的顶点位置,Cu替代a位置Fe后,晶胞中少一个Fe多一个Cu,故更稳定的Cu替代型产物的化学式为Fe3CuN ;
(4)乙酰基结构中,碳原子有三种,甲基中的C是sp3杂化,羰基中的C是sp2杂化,5元C环中的C是sp2杂化;故乙酰基二茂铁中碳原子的杂化方式有sp3、sp2;亚铁离子具有强还原性,及Fe2+亚铁离子容易失电子,Fe2+的3d轨道有6个电子,失去1个电子后3d轨道电子排布处于半充满稳定状态,故其具有强还原性;
(5)由金刚石的晶胞结构可以知道,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,在BN晶体中,每个B原子和4个N原子形成共价键,B原子的配位数是4,B原子与N原子之间共价键的数目是12,所以B原子与N原子之间共价键的数目与配位键的数目比为![]() ,根据晶胞结构图,以晶胞顶点上的氮原子为例,与该氮原子距离最近的氮原子位于经过该顶点的面的面心上,这样的原子有12个,根据均摊可以知道,一个晶胞中N原子数目为 4,B原子数目也是4,根据
,根据晶胞结构图,以晶胞顶点上的氮原子为例,与该氮原子距离最近的氮原子位于经过该顶点的面的面心上,这样的原子有12个,根据均摊可以知道,一个晶胞中N原子数目为 4,B原子数目也是4,根据![]() 可以知道晶胞的体积
可以知道晶胞的体积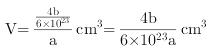 ,所以晶胞的边长为
,所以晶胞的边长为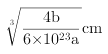 ,最近的两个N原子间距离是晶胞面对角线的
,最近的两个N原子间距离是晶胞面对角线的![]() ,所以晶体中最近的两个N原子间距离是
,所以晶体中最近的两个N原子间距离是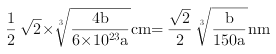 。
。

【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题:
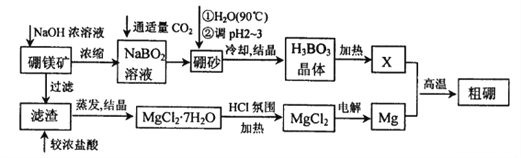
(1)硼砂中B的化合价为_________;滤渣的主要成分为_______________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_________________________。
(3)H3BO3是一种一元弱酸,也可写作B(OH)3,它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为______________________________。
(4)MgCl2·6H2O需要在HCl氛围中加热,其目的是______________________。
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为_______________。
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
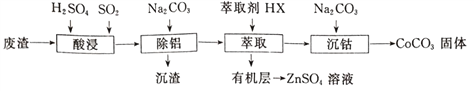
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。