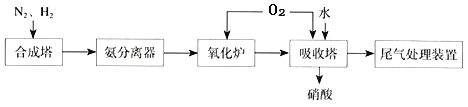
题目内容
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/c(CH3COOH)c(OH-)增大
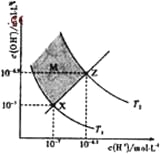
C. 向盐酸中加入氨水至中性,溶液中![]() >1
>1
D. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
【答案】D
【解析】
A.Ka= ![]() ,加水虽促进电离,n(CH3COO-)增大,但c(CH3COO-)减小,Ka保持不变,则溶液中
,加水虽促进电离,n(CH3COO-)增大,但c(CH3COO-)减小,Ka保持不变,则溶液中![]() 增大,A项错误;
增大,A项错误;
B.20℃升温至30℃,促进CH3COO-水解,且Kh增大,则溶液中![]() 减小,B项错误;
减小,B项错误;
C.向盐酸中加入氨水呈中性,则c(H+)=c(OH-),电荷守恒可知,溶液中c(NH4+)=c(Cl-),即![]() =1,C项错误;
=1,C项错误;
D.常温下,pH=2的醋酸溶液,醋酸为弱酸,c(CH3COOH)>10-2mol/L,pH=12的NaOH溶液,c(NaOH)=10-2mol/L,两者中和后酸过量,因而溶液显酸性,即pH<7,D项正确。
故答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】乙酰苯胺是一种具有退热镇痛作用的药物,可用苯胺和冰醋酸为原料来制备乙酰苯胺。
①化学原理为: (已知:苯胺易被氧化)
(已知:苯胺易被氧化)
②相关物质的物理常数
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | |||||
苯胺 | 93 | 无色液体 | 6 | 184 | 3.42(20℃) | 任意比混溶 |
冰醋酸 | 60 | 无色液体 | 17 | 118 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 白色片状固体 | 114 | 304 | 0.56(20℃)、3.45(50℃)、5.20(100℃) | 36.9(20℃) |
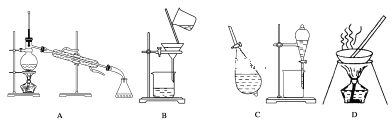
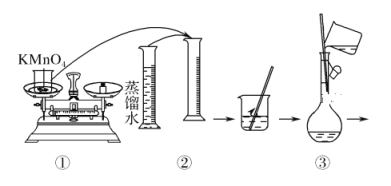
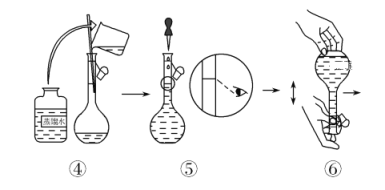
③制各乙酰苯胺的装置如图所示:韦氏分馏柱作用与原理类似于冷凝管。
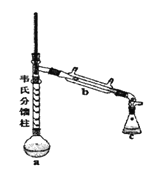
④制备方法和过程:

(1)仪器a的名称_______。
(2)制备过程中加入锌粒的作用:其一是________、其二是防止暴沸。
(3)从化学平衡的角度分析,步骤1要控制分馏柱上端的温度在105℃左右的原因_____。
(4)步骤2
(5)步骤3中洗涤剂最好选择________。
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(6)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→_____→冷却结晶→过滤→洗涤→干燥。
(7)本实验所得到的乙酰苯胺产率是________。