题目内容
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(Ⅰ)、氨水]吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:___。
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___,其中氮元素原子最外层电子排布的轨道表示式是___,通过比较___可判断氮、磷两种元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是___。
(5)CS2熔点高于CO2,其原因是___。
【答案】bc 2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3 C>N>O>H ![]() NH3和PH3的稳定性
NH3和PH3的稳定性 ![]() 二者都为分子晶体,相对分子质量越大,分子间作用力越大
二者都为分子晶体,相对分子质量越大,分子间作用力越大
【解析】
铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac。增大浓度、升高温度等,可增大反应速率。CS2和CO2均为分子晶体。
[Cu(NH3)3CO]Ac。增大浓度、升高温度等,可增大反应速率。CS2和CO2均为分子晶体。
(1)a.减压反应速率减小,a错误;
b.增大浓度,可增大反应速率,b正确;
c.升高温度,增大反应速率,c正确;
d.减小生成物浓度,反应速率减小,d错误;
答案选bc。
(2)氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵,方程式为2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3。
(3)铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,则原子半径C>N>O>H,氮元素原子最外层为第二层有5个电子,电子排布的轨道表示式是![]() ;比较非金属性强弱,可根据氢化物的稳定性强弱。
;比较非金属性强弱,可根据氢化物的稳定性强弱。
(4)CS2的电子式类似于CO2,电子式为![]() ,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高。
,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高。

 阅读快车系列答案
阅读快车系列答案【题目】下表是四种盐在不同温度下的溶解度(g/100g水):(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
NaNO3 | KNO3 | NaCl | KCl | |
10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
100℃ | 175 | 246 | 39.1 | 56.6 |
用物质的量之比为1:1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示
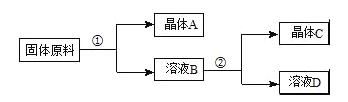
以下说法错误的是( )
A.①和②的实验过程中,都需要控制温度
B.①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
C.②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
D.用95%的酒精洗涤所得的硝酸钾晶体比较好