题目内容
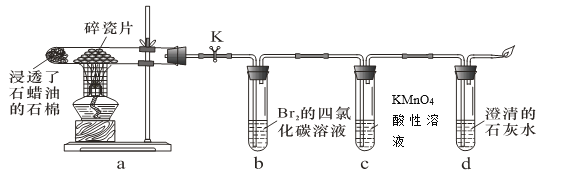
【题目】乙炔在不同条件下可以转化成许多化合物,如图,下列叙述错误的是( )
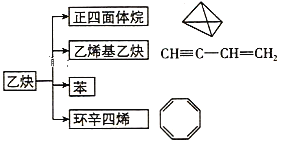
A. 正四面体烷的一氯代物及二氯代物均只有1种
B. 乙炔生成乙烯基乙炔是加成反应
C. 等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不同
D. ![]() 与环辛四稀互为同分异构体,1mol的两种混合物都能最多和4mol H2加成
与环辛四稀互为同分异构体,1mol的两种混合物都能最多和4mol H2加成
【答案】C
【解析】
A.正四面体烷中每个C上只有1个H,且只有一种相邻位置,则正四面体烷的二氯代物只有1种,四个氢完全等效,一氯代物也只有一种,故A正确;
B.乙炔生成乙烯基乙炔,发生碳碳三键的加成反应,故B正确;
C.苯与乙烯基乙炔的最简式均为CH,所以等质量的苯与乙烯基乙炔完全燃烧时的耗氧量相同,故C错误;
D.![]() 与环辛四稀的分子式均为C8H8,互为同分异构体,1mol
与环辛四稀的分子式均为C8H8,互为同分异构体,1mol![]() 或环辛四稀均能和4molH2发生加成反应,则1mol两种混合物最多和4mol H2加成,故D正确;
或环辛四稀均能和4molH2发生加成反应,则1mol两种混合物最多和4mol H2加成,故D正确;
故答案为C。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
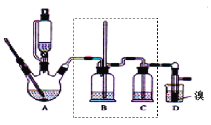
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入___,其目的是_____,装置A中生成副产物乙醚的化学反应方程式 ______。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放_____
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_____的方法除去。