题目内容
【题目】常温下,向20mL0.1![]() 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是

A. 常温下,0.1![]() 氨水中
氨水中![]() 的电离常数K约为
的电离常数K约为![]()
B. a、b之间的点一定满足,![]()
C. c点溶液中![]()
D. d点代表两溶液恰好完全反应
【答案】A
【解析】
NH3·H2O电离出OH-抑制水的电离;向氨水中滴加HCl,反应生成NH4Cl,NH4+的水解促进水的电离,随着HCl的不断滴入,水电离的c(H+)逐渐增大;当氨水与HCl恰好完全反应时恰好生成NH4Cl,此时水电离的c(H+)达到最大(图中c点);继续加入HCl,盐酸电离的H+抑制水的电离,水电离的c(H+)又逐渐减小;据此分析。
A. 常温下,0.1mol/L的氨水溶液中水电离的c(H+)=10-11mol/L,氨水溶液中H+全部来自水电离,则溶液中c(H+)=10-11mol/L,c(OH-)=![]() mol/L=10-3mol/L,Ka=
mol/L=10-3mol/L,Ka= =
=![]() mol/L=1
mol/L=1![]() 10-5mol/L,所以A选项是正确的;
10-5mol/L,所以A选项是正确的;
B.a、b之间的任意一点,水电离的c(H+)<1×10-7mol/L,溶液都呈碱性,则c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH4+),故B错误;
C.根据图知,c点水电离的H+达到最大,溶液中溶质为NH4Cl,NH4+水解溶液呈酸性,溶液中c(H+)>10-7mol/L,c(OH-)<10-7mol/L,结合电荷守恒得: c(NH4+)<c(Cl-),故C错误;
D. 根据上述分析,d点溶液中水电离的c(H+)=10-7mol/L,此时溶液中溶质为NH4Cl和HCl,故D错误。
所以A选项是正确的。

【题目】元素周期表中的四种元素![]() 的有关信息如下,请用合理的化学用语填写空白。
的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 |
|
|
|
| |
长周期元素 |
|
|
|
|
(1)![]() 元素周期表中的位置为___________,
元素周期表中的位置为___________,![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为__________。
三种元素的简单离子半径从大到小的顺序为__________。
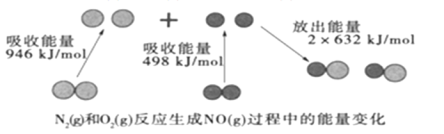
(2)足量![]() 的最高价氧化物的水化物的稀溶液与
的最高价氧化物的水化物的稀溶液与![]() 甲完全反应,放出热量
甲完全反应,放出热量![]() ,请写出表示该过程中和热的热化学方程式____________。
,请写出表示该过程中和热的热化学方程式____________。
(3)下列有关![]() 的气态氢化物丁的说法正确的有_____________(选填字母)
的气态氢化物丁的说法正确的有_____________(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性强 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________;乙的水溶液呈酸性,请写出离子方程式解释原因_____________。
(5)![]() 是一种弱酸,请写出它的电离方程式__________________;
是一种弱酸,请写出它的电离方程式__________________;![]() 溶液有剧毒,可以用
溶液有剧毒,可以用![]() 溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,
溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,![]() 的电离常数
的电离常数![]() ,在
,在![]() 的
的![]() 溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的
溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的 _____________。
_____________。