题目内容
【题目】元素周期表中的四种元素![]() 的有关信息如下,请用合理的化学用语填写空白。
的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 |
|
|
|
| |
长周期元素 |
|
|
|
|
(1)![]() 元素周期表中的位置为___________,
元素周期表中的位置为___________,![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为__________。
三种元素的简单离子半径从大到小的顺序为__________。
(2)足量![]() 的最高价氧化物的水化物的稀溶液与
的最高价氧化物的水化物的稀溶液与![]() 甲完全反应,放出热量
甲完全反应,放出热量![]() ,请写出表示该过程中和热的热化学方程式____________。
,请写出表示该过程中和热的热化学方程式____________。
(3)下列有关![]() 的气态氢化物丁的说法正确的有_____________(选填字母)
的气态氢化物丁的说法正确的有_____________(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性强 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________;乙的水溶液呈酸性,请写出离子方程式解释原因_____________。
(5)![]() 是一种弱酸,请写出它的电离方程式__________________;
是一种弱酸,请写出它的电离方程式__________________;![]() 溶液有剧毒,可以用
溶液有剧毒,可以用![]() 溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,
溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,![]() 的电离常数
的电离常数![]() ,在
,在![]() 的
的![]() 溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的
溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的 _____________。
_____________。
【答案】第三周期Ⅲ![]() 族
族 ![]()
![]()
![]() ac
ac ![]()
![]()
![]()
![]()
![]()
【解析】
![]() 的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液,则甲为氢氧化铝,X为Al元素;
的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液,则甲为氢氧化铝,X为Al元素;![]() 的一种氢化物可用于制造纯碱和做制冷剂,则该氢化物为氨气,Y为N元素;
的一种氢化物可用于制造纯碱和做制冷剂,则该氢化物为氨气,Y为N元素;![]() 的一种盐乙可以做净水剂,
的一种盐乙可以做净水剂,![]() 的某种氧化物丙可以做红色涂料,则丙为氧化铁,乙为铁盐,Z为Fe元素;
的某种氧化物丙可以做红色涂料,则丙为氧化铁,乙为铁盐,Z为Fe元素;![]() 元素大量存在于海藻中,它的银盐可用于人工降雨,则W为I元素,再结合元素周期律与物质的性质分析作答。
元素大量存在于海藻中,它的银盐可用于人工降雨,则W为I元素,再结合元素周期律与物质的性质分析作答。
根据上述分析可知,X、Y、Z和W分别为Al、N、Fe和I元素,则:
(1)![]() 元素为Al,原子序数为13,在周期表中的位置为第三周期Ⅲ
元素为Al,原子序数为13,在周期表中的位置为第三周期Ⅲ![]() 族;原子的电子层数越大,其原子半径越大,电子层数相同时,其离子半径随着原子序数增大而减小,则
族;原子的电子层数越大,其原子半径越大,电子层数相同时,其离子半径随着原子序数增大而减小,则![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为
三种元素的简单离子半径从大到小的顺序为![]() ,
,
故答案为:第三周期Ⅲ![]() 族;
族;![]()
(2)![]() 的最高价氧化物的水化物为
的最高价氧化物的水化物为![]() 完全反应,放出热量
完全反应,放出热量![]() ,则反应生成1mol水所放出的热量为
,则反应生成1mol水所放出的热量为![]() ,则表示该过程中和热的热化学方程式为
,则表示该过程中和热的热化学方程式为![]()
![]() ,
,
故答案为:![]()
![]() ;
;
(3)![]() 的气态氢化物丁为HI,则:
的气态氢化物丁为HI,则:
a. HCl与HI均为分子化合物,其分子间作用力越大,沸点越高,则分子间作用力比较:HI>HCl,则沸点比较:HI>HCl,a项正确;
b. 非金属性越强,对应气态氢化物的稳定性越高,则碘化氢比氯化氢稳定性低,b项错误;
c. 同族元素中非金属性从上到下依次减弱,单质的氧化性依次减弱,相应离子的还原性依次增强,则碘化氢比氟化氢还原性强,c项正确;
d. 氟化氢为弱酸,碘化氢为强酸,则碘化氢比氟化氢酸性强,d项错误;
答案选ac;
(4)丙为氧化铁,丁为HI,两者会发生氧化还原反应,其离子方程式为:![]() ,乙为铁盐,在溶液中会水解显酸性,其离子方程式为:
,乙为铁盐,在溶液中会水解显酸性,其离子方程式为:![]() ,
,
故答案为:![]() ;
;![]() ;
;
(5)HY3为HN3,是一种弱酸,则在水溶液中发生弱电离,其离子方程式为:![]() ;NaClO与NaN3发生氧化还原反应,其离子方程式为:
;NaClO与NaN3发生氧化还原反应,其离子方程式为:![]() ;
;![]() 的电离常数
的电离常数![]() ,则根据表达式
,则根据表达式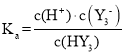 可知,
可知,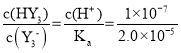 =5×10-3=0.005,
=5×10-3=0.005,
故答案为:![]() ;
;![]() ;
;![]() 。
。