题目内容
【题目】现有如下两个反应:a.NaOH+HCl=NaCl+H2O b.Cu+2Ag+ =Cu2+ +2Ag
(1)反应____(填字母)不能设计成原电池。原因是__________________________。
(2)a反应为______反应(填“放热”或“吸热”),NaOH和HCl的总能量________(填“大于”“小于”或“等于”)NaCl和H2O的总能量。
(3)已知HCl中H-Cl键的键能为431 kJ·mol-1,则断开1molH-Cl键_____431 kJ的能量,形成1molH-Cl键_____431 kJ的能量。(填“吸收”或“放出”)
(4)反应____(填字母)能设计成原电池,请画出实验装置图,注明电极材料和电解质溶液。__________

写出电极反应式及反应类型
正极反应式:_____________________,
反应类型:_______________________,
负极反应式:_____________________。
(5)上题所设计原电池中,向正极移动的离子为_______,电池工作一段时间后,电解质溶液质量减轻7.6g,正极增重的质量为_______。
【答案】a a不是氧化还原反应 放热 大于 吸收 放出 b 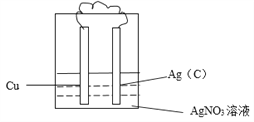 2Ag++2e-=2Ag 还原反应 Cu-2e-=Cu2+ Ag+ 10.8g
2Ag++2e-=2Ag 还原反应 Cu-2e-=Cu2+ Ag+ 10.8g
【解析】
(1)反应a不是氧化还原反应,所以不能设计成原电池;(2)a反应是中和反应,一定为放热反应,因此NaOH和HCl的总能量大于NaCl和H2O的总能量。(3)已知HCl中H-Cl键的键能为431 kJ·mol-1,则断开1molH-Cl键吸收431 kJ的能量,形成1molH-Cl键放出431 kJ的能量。(4)反应b是置换反应,属于氧化还原反应,能设计成原电池,铜失去电子,铜是负极,银离子得到电子,则装置图可以是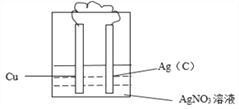 ,其中正极发生得到电子的还原反应,反应式为2Ag++2e-=2Ag,负极发生失去电子的氧化反应,反应式为Cu-2e-=Cu2+。(5)原电池中,阳离子向正极移动,则向正极移动的离子为Ag+。电池工作一段时间后,电解质溶液质量减轻7.6g,设消耗铜是xmol,则析出银是2xmol,所以2x×108-64x=7.6,解得x=0.05,所以正极增重的质量为0.1mol×108g/mol=10.8g。
,其中正极发生得到电子的还原反应,反应式为2Ag++2e-=2Ag,负极发生失去电子的氧化反应,反应式为Cu-2e-=Cu2+。(5)原电池中,阳离子向正极移动,则向正极移动的离子为Ag+。电池工作一段时间后,电解质溶液质量减轻7.6g,设消耗铜是xmol,则析出银是2xmol,所以2x×108-64x=7.6,解得x=0.05,所以正极增重的质量为0.1mol×108g/mol=10.8g。

 阅读快车系列答案
阅读快车系列答案