题目内容
在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )
A.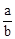 mol·L-1 mol·L-1 | B.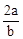 mol·L-1 mol·L-1 | C.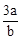 mol·L-1 mol·L-1 | D.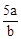 mol·L-1 mol·L-1 |
A
解析试题分析:往FeBr2溶液中通入Cl2,由于还原性Fe2+>Br -,所以Fe2+ 先被氧化,所以设bLFeBr2溶液的浓度为c,则有:
2Fe2+ + Cl2 = 2F3++2Cl- 2Br - + Cl2 = Br2+2Cl-
2 : 1 2 : 1
bc 0.5bc bc 0.5bc
所以n(Cl2)=bc=amol,所以c=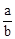 mol·L-1 ,故选B。
mol·L-1 ,故选B。
考点:本题考查氧化还原反应的简单计算。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。则下列说法正确的是( )
| A.反应过程中,被氧化与被还原的元素的物质的量之比为2︰1 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 |
| D.若反应中生成1.0mol HNO3,转移的电子数目为6.02×1023 |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.反应后的溶液中n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
已知氧化还原反应反应 K2Cr2O7 + 14HCl ="=" 2KCl + 2CrCl3 + 3Cl2+ 7H2O
="=" 2KCl + 2CrCl3 + 3Cl2+ 7H2O
关于该反应的说法中正确的组合是
①氧化剂是K2Cr2O7 ②还原性:Cl->Cr3+
③每生成1mol Cl2,电子转移为6mol ④CrCl3是氧化产物
| A.①② | B.①②④ | C.①③④ | D.①③ |
下列说法正确的是
| A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强 |
| B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为: Fe3+ > Cu2+ > Fe2+ |
| C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和反应 2C- + B2 = 2B- +C2都能发生 |
| D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
下列褪色过程不是因为发生氧化还原反应而褪色的是
| A.将氯水滴入到干燥的红布条上,红色布条褪色 |
| B.将SO2气体通入品红溶液中,品红溶液褪色 |
| C.将SO2气体通入酸性高锰酸钾溶液中,溶液褪色 |
| D.向含有I2的淀粉溶液中加入KOH溶液,蓝色褪去 |
ClO2是一种消毒杀菌效率高、污染小的水处理剂。实验室可通过以下反应制得ClO2。2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
| A.KClO3在反应中是还原剂 |
| B.1 mol KClO3参加反应,在标准状况下能得到22.4 L气体 |
| C.在反应中H2C2O4既不是氧化剂也不是还原剂 |
| D.1 mol KClO3参加反应有1 mol电子转移 |
在KClO3+6HCl=3Cl2↑+ KCl+3H2O中,有30 mole-转移,生成的氯气在标准状况下的体积为( )
| A.22.4L | B.336.0L | C.403.2L | D.672.0L |
下列变化需要加入适当的氧化剂才能完成的是
| A.CuO→Cu | B.Fe→FeCl3 | C.H2SO4→H2 | D.HNO3→N2 |