题目内容
下列变化需要加入适当的氧化剂才能完成的是
| A.CuO→Cu | B.Fe→FeCl3 | C.H2SO4→H2 | D.HNO3→N2 |
B
解析试题分析:氧化剂在反应中得到电子,元素的化合价降低,因此如果变化需要加入适当的氧化剂才能完成,这说明选项中物质是还原剂,有关元素的化合价升高。A、转化CuO→Cu中铜元素的化合价降低,需要加入还原剂,A不正确;B、转化Fe→FeCl3中铁元素的化合价升高,需要加入氧化剂,B正确;C、转化H2SO4→H2中氢元素的化合价降低,需要加入还原剂,C不正确;D.转化HNO3→N2中氮元素的化合价降低,需要加入还原剂,D不正确,答案选B。
考点:考查氧化还原反应的应用与判断

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )
A.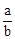 mol·L-1 mol·L-1 | B.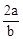 mol·L-1 mol·L-1 | C.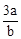 mol·L-1 mol·L-1 | D.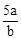 mol·L-1 mol·L-1 |
下列自然、生活中的事例不属于氧化还原反应的是
| A.动物呼吸 | B.植物光合作用 | C.金属生锈 | D.石膏点制豆腐 |
下列反应中氯元素仅被还原的是
| A.5Cl2+I2+6H2O=10HCl+2HIO3 |
| B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
| D.HCl+NaOH=NaCl+H2O |
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与上述反应在氧化还原原理上最相似的反应是
| A.2NaBr+Cl2=2NaCl+Br2 |
B.2KMnO4 K2MnO4+MnO2+O2 ↑ K2MnO4+MnO2+O2 ↑ |
| C.2H2S+SO2="3S" ↓+2H2O |
| D.2FeCl3+H2S=2FeCl2+S ↓+2HCl |
下列说法中,正确的是( )
| A.失去电子的物质是还原剂,具有氧化性 |
| B.氧化还原反应的本质是元素化合价的升降 |
| C.氧化还原反应中,某元素由化合态变为游离态,此元素可能被还原或被氧化 |
| D.在氧化还原反应中,电子不可以在同种元素间转移 |
根据下列各反应,判断有关物质还原性由强到弱的顺序是( )
① H2SO3+I2+H2O = 2HI + H2SO4
② 2FeCl3+2HI=2FeCl2 + 2HCl + I2
③ 3FeCl2 + 4HNO3=2FeCl3 + NO↑ + 2H2O +Fe(NO3)3
| A.FeCl2>HI>H2SO3>NO | B.H2SO3>HI>FeCl2>NO |
| C.I2>FeCl2>H2SO3>NO | D.NO>FeCl2>H2SO3>HI |
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中Na2FeO4是还原产物 |
| C.Na2FeO4 中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2 mol FeCl3发生反应,转移电子的物质的量为 6 mol |
下列过程中涉及化学变化,且属于氧化还原反应的是
| A.家庭中经常用食醋浸泡有水垢的水壶 |
| B.甘油加水作护肤剂 |
| C.烹鱼时,加入少量的酒和食醋可减少腥味,增加香味 |
| D.交通警察用酸性重铬酸钾检查司机是否酒后驾车 |