题目内容
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.反应后的溶液中n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
C
解析试题分析:NaCl、NaClO、NaClO3共存体系中钠离子、氯原子个数比是1:1.n(Na+)=0.03mol×10.00mol/L=0.3mol.所以n(Cl2)=1/2n(Cl-)=1/2n(Na+)=0.15mol.A、 B错误。 C.假如全部生成NaClO.则发生反应:Cl2+2NaOH=NaCl+NaClO+H2On=1/2n(NaOH)=0.15.假如全部生成NaClO3.则发生反应:Cl2+6NaOH=5NaCl+NaClO3+3H2O,n=5/6n(NaOH)=0.25.现在形成NaCl、NaClO、NaClO3共存体系,所以转移电子为:0.15<n<0.25。正确。D根据电子守恒可得:n(NaCl)=n(NaClO)+5n(NaClO3)。故错误。选项为:C。
考点:考查原子守恒、电子守恒的知识。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
| A.2 mol | B.1 mol | C.0.5 mol | D.0.25 mol |
下列氧化还原反应中,水作为氧化剂的是( )
A.CO + H2O CO2 + H2 CO2 + H2 |
| B.3NO2+ H2O = 2HNO3 + NO |
| C.2Na2O2 + 2H2O =" 4NaOH" + O2↑ |
| D.2F2 + 2H2O =" 4HF" + O2 |
已知NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是( )
| A.NH4CuSO3中硫元素被氧化了 |
| B.刺激性气味的气体是二氧化硫和氨气的混合气体 |
| C.该反应中NH4CuSO3既作氧化剂又作还原剂 |
| D.该反应中硫酸既表现为酸性又表现强氧化性 |
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO) ( )
| A.0.448 L | B.0.672 L | C.0.896 L | D.0.224 L |
14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为
| A.9.6g | B.6.4g | C.3.2g | D.1.6g |
下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是
①2HClO4+Br2(气) = 2HBrO4+Cl2
②2NaBr+Cl2= 2NaCl+Br2
③2KI+Cl2= 2KCl+I2
④2KI+Br2= 2KBr+I2
| A.①②③ | B.①②④ | C.②③④ | D.①②③④ |
在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )
A.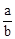 mol·L-1 mol·L-1 | B.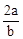 mol·L-1 mol·L-1 | C.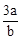 mol·L-1 mol·L-1 | D.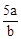 mol·L-1 mol·L-1 |
下列自然、生活中的事例不属于氧化还原反应的是
| A.动物呼吸 | B.植物光合作用 | C.金属生锈 | D.石膏点制豆腐 |